胶质母细胞瘤的新兴治疗
2014-10-28 16:59:45 来源: 丁香园 作者: 评论:0 点击:
丁香园 作者: 评论:0 点击:
近期,JAMA Neurology 杂志发表综述,回顾了胶质母细胞瘤的基因组、表观遗传、转录、蛋白质组特征以及脑内微环境和免疫系统交互影响,阐述了以肿瘤生长因子受体及下游信号通路、 血管新生、干细胞样癌细胞、细胞周期的调节为靶点以及溶瘤病毒、新颖放射技术和免疫治疗等新兴的治疗策略。
胶质母细胞瘤是最常见的原发性脑肿瘤,在美国的年发病率为 3.19/10 万人,目前标准治疗为手术切除后放疗,辅助替莫唑胺的联合方案。尽管采用此种多模式的治疗方法,但胶质母细胞瘤的平均生存时间为 16~ 19 个月,约 25%~ 30% 的患者在诊断 2 年后仍存活。
表现出 DNA 修复酶 O- 甲基鸟嘌呤甲基转移酶表观沉默的患者,结局更佳。最近一项 3 期临床试验调查了替莫唑胺的疗效,表达 O- 甲基鸟嘌呤甲基转移酶启动子的肿瘤患者接受了 21 个月的治疗,而无甲基化的肿瘤患者治疗时间为 14 个月。
但结果表明,全部患者的病情均有进展,在进展期,传统的、具有细胞毒性的化疗(卡莫司汀、洛莫司汀或卡铂)效果不佳。通过调控血管内皮生长因子(vascular endothelial growth factor ,VEGF)通路,抑制血管生成的贝伐珠单抗,最近得到美国 FDA 批准,可用于治疗胶质母细胞瘤。
两项 2 期试验表明, 该药具有高反应率(28.3% 和 37.8%),可延长无进展生存期(16 周)。近期,两项 2 期研究采用贝伐珠单抗联合标准放化疗治疗新诊断的患者,发现可改善无进展生存期,但总生存期无改善。
考虑到现行治疗的低生存率,迫切需要治疗胶质母细胞瘤的新方法。本综述关注于临床试验中根据胶质母细胞瘤肿瘤基因学进展转化而来的新颖治疗。
胶质母细胞瘤分子分型的进展
胶质母细胞瘤在组织学和基因上为异质性肿瘤,根据有无低级别的胶质瘤而在组织学上分为原发性和继发性两类。近期基因组分析进一步支持了该假说:原发性和继发性反映着不同的肿瘤成因。
原发性胶质母细胞瘤是该病最常见的类型,而原发性胶质母细胞瘤最常见的基因突变位点为端粒酶逆转录酶基因(TERT; OMIM 187270)的启动子区,该突变见于 54%~ 83% 的肿瘤。TERT 启动子突变与信使 RNA 高表达水平相关,这可能是原发性胶质细胞瘤端粒酶功能增强的重要原因。
TERT 突变也见于绝大多数的少突神经胶质瘤,但少见于 II 和 III 级星形细胞瘤。ATRX(OMIM 300032)和 IDH1(OMIM 147700)的突变,常见于星形细胞瘤和继发性胶质母细胞瘤。
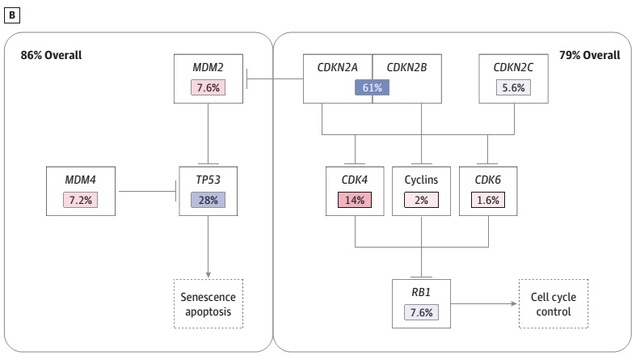
原发性胶质母细胞瘤是首个被美国癌症和肿瘤基因图谱(Cancer Genome Atlas,TCGA)计划详细分析基因组、表观遗传、转录和蛋白质组的固态肿瘤,基因编码序列最常见的改变以 3 个通路为主(见图 1):视网膜母细胞瘤蛋白肿瘤抑制因子通路、P53 肿瘤抑制因子通路、受体酪氨酸激酶(receptor tyrosine kinase,RTK)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路。
图 1. (A)原发性胶质母细胞瘤的基因突变、DNA 局部扩增和 PI3/ MAPK 通路的基因缺失;(B)p53 和视网膜母细胞瘤蛋白肿瘤抑制因子通路。
根据基因表达和 DNA 甲基化的模式对胶质母细胞瘤进行分子分型,手术切除的、未治疗的原发性胶质母细胞瘤可分为 4 个转录组:经典性、原神经性、间质性和神经性。
原发性胶质母细胞瘤经典性转录亚型以 7 号染色体的获得和 10 号染色体的丢失为特征,多数病例可见表皮生长因子受体(epidermal growth factor receptor,EGFR)扩增和突变。最常见的 EGFR 突变(OMIM 131550)为外显子 2-7 框内缺失,称为 EGFRvIII,见于 25% 的原发性胶质母细胞瘤。EGFR 点突变也很常见,占肿瘤的 25%;但该亚型未见有肿瘤抑制基因 TP53(OMIM 191170)的突变。
原神经性原发性胶质母细胞瘤与血小板源性生长因子受体 A( PDGFRA; OMIM 173490)的扩增有关,常包括染色体 4q12 上的 KDR (OMIM 173490)和 KIT (OMIM 164920)基因突变(编码产物为 RTK),以及少突胶质细胞发育基因 NKX-2(OMIM 604612)和 Olig2(OMIM 606386)的过表达。
TP53 突变也很常见。IDH1 突变可见于原神经性原发性胶质母细胞瘤,与胶质瘤总生存期的增加有关,是 WHO II 级和 III 级星形细胞瘤和少突胶质细胞瘤的特征性突变。
在表观遗传水平,IDH 突变型肿瘤在某些 DNA 驱动子区域(如胶质瘤 -CpG 岛甲基子表型,glioma-CpG island methylator phenotype,G-CIMP)存在超甲基化。而多数的 G-CIMP 肿瘤存在 IDH 突变。G-CIMP 和 IDH 突变是胶质母细胞瘤较为理想的预后标志物,IDH 野生型或非 G-CIMP 的原神经性原发性胶质母细胞瘤,行为激进,预后较差。
间质性胶质母细胞瘤过度表达间质性标志物,与染色体 17q11 上 NF1 基因(OMIM 162200)的缺失和沉默突变有关,导致神经纤维瘤蛋白表达的下降。PTEN 基因(OMIM 601728)点突变也常见于该亚型,
目前对于神经性胶质母细胞瘤所知甚少,该亚型以表达神经元标记物为特征,常过表达 EGFR。
还可根据 DNA 甲基化的模式(而非基因表达)分类原发性胶质母细胞瘤。非 GCIMP DNA 甲基化亚型与转录亚型不完全重合。研究正在探讨不同的胶质母细胞瘤分类与特异性治疗、临床试验的结果之间的关系。
肿瘤发生通路
2/3 的原发性胶质母细胞瘤可见 RTK 的突变或扩增(图 2)。多种生长因子依赖 RTKs 进行信号转导,包括血小板源性生长因子、表皮生长因子、血管内皮生长因子、成纤维细胞生长因子、肝细胞生长因子和胰岛素样生长因子。
各种生长因子的信号转导机制相似:生长因子与受体结合,引起受体二聚化,随后细胞内酪氨酸残基催化单元自体磷酸化,下游的磷脂酰肌醇 -3- 激酶(phosphatidylinositol 3-kinases,PI3K)通路或 Ras G 蛋白偶联受体通路激活。
活化的 PI3K 可刺激 Akt 和哺乳动物的雷帕霉素靶蛋白,引起基因转录和细胞存活;PI3K 的活性受肿瘤抑制基因 PTEN 调控。活化的 Ras 可通过 Raf-1、丝裂原活化蛋白激酶激酶和 MAPK 的活动,引起细胞增殖。
在胶质母细胞瘤中,RTK 信号可通过通路中一些突变的作用而被放大,包括受体本身,譬如,EGFR 或 PDGFR 增殖 / 突变(67%)、PI3K 亚单位 PIK3CA 或 PIK3R1 的突变(25%)、通路中调节蛋白 PTEN 和 NF1 单倍剂量不足和 / 或突变等。超过 90% 的原发性胶质母细胞瘤可见 PI3K 或 MAPK 通路的一个或多个改变。
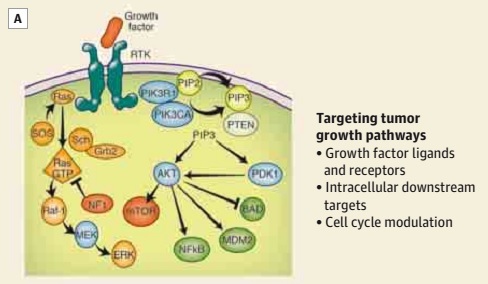
图 2A. 胶质母细胞瘤的治疗策略可以肿瘤的生长通路(生长因子配体和受体、细胞内下游靶点和细胞周期的调节)为靶向。
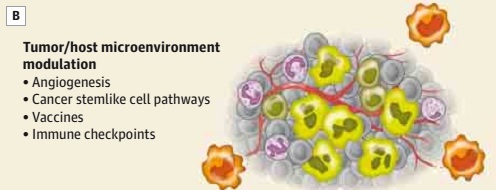
图 2B. 治疗策略还包括微环境的改变,包括血管生成、干细胞样癌细胞通路、疫苗和免疫检测点的调节。图中亮绿色和灰色细胞代表肿瘤细胞,桔色为干细胞样胶质瘤细胞,紫色为免疫效应细胞,深绿色为免疫调节细胞,红色线为血管。
图 2C. 治疗必须越过血脑屏障接近肿瘤。图中绿色肿块代表胶质母细胞瘤。
RTK 信号通路是药物治疗十分有吸引力的靶点,因为该通路常发生基因突变,且相对了解较多,其它癌症中针对该通路的药物已取得成功。小分子酪氨酸激酶抑制剂可与三磷酸腺苷竞争,阻碍受体激活以及受体后信号的转导。然而,第一代 EGFR 和 PDGFR 酪氨酸激酶抑制剂、哺乳动物靶蛋白雷帕霉素 Akt、以及近期关于 PI3K 抑制剂的临床试验表明,对胶质母细胞瘤的疗效不佳。
一些因素可解释此种不良结局,多数的临床试验未根据基因突变或过表达的情况筛选患者,而这是药物成功治疗的靶点所在。此外,一些药物对血脑屏障的渗透性较低;存在其它信号通路或反馈环路可代偿靶蛋白作用,引起内在抗药;获得性突变所导致的抗药性也可能导致试验失败。
目前的试验正努力克服上述难题:研发对胶质母细胞瘤基因突变更具特异性的新抑制剂;通过大剂量给药改善血脑屏障的渗透性;严格限制入选的受试者人群;治疗同时针对多条信号通路(包括针对多靶点的酪氨酸激酶抑制剂)、药物联合治疗;钙离子信号阻滞剂也在探讨之中。
表 1. 以胶质母细胞瘤常见、活化的生长因子通路为靶点的药物
|
药物 |
EGFR |
PDGFR |
VEGF |
mTOR |
PI3K |
|
AEE788 |
X |
X |
|||
|
阿法替尼(Afatinib) |
X |
||||
|
阿西替尼(Axitinib) |
X |
X |
|||
|
卡博替尼(Cabozantinib) |
X |
||||
|
西地尼布(Cediranib) |
X |
X |
|||
|
达可替尼(Dacomitinib) |
X |
||||
|
达沙替尼(Dasatinib) |
X |
||||
|
多韦替尼(Dovitinib) |
X |
X |
|||
|
埃罗替尼(Erlotinib) |
X |
||||
|
吉非替尼(Gefitinib) |
X |
||||
|
伊马替尼(Imatinib) |
X |
||||
|
拉帕替尼(Lapatinib) |
X |
||||
|
尼达尼布(Nintedanib) |
X |
X |
|||
|
索拉非尼(Sorafenib) |
X |
X |
|||
|
舒尼替尼(Sunitinib) |
X |
X |
|||
|
坦度替尼(Tandutinib) |
X |
||||
|
凡德他尼(Vandetanib) |
X |
X |
|||
|
依维莫司(Everolimus) |
X |
||||
|
西罗莫司(Sirolimus) |
X |
||||
|
他克莫司(Tacrolimus) |
X |
||||
|
CC-115 X |
X |
||||
|
XL765(SAR245409) |
X |
X |
|||
|
XL147(SAR245408) |
X |
||||
|
PX866 |
X |
||||
|
BKM120(buparlisib) |
X |
注释:mTOR:mammalian target of rapamycin,哺乳动物类雷帕霉素靶蛋白。
胶质母细胞瘤常见 TP53 突变或影响 p53 功能的突变,发生率约为 85%。TP53 作为肿瘤抑制基因,参与细胞周期调节,还可作为转录因子。p53 活化可上调参与细胞周期静息和凋亡的多种基因的表达,p53 抑制剂 MDM2 或 MDM4、稳定 p53 的 p14/ARF 基因缺失、单等位基因 TP53 突变等,可令 p53 的失活。
现在,抑制 p53 突变 DNA 绑定结构域的小分子和肽类正在研发中,可恢复剩余野生型等位基因的肿瘤抑制功能。到目前为止,针对胶质母细胞瘤的、以 p53 为靶点的药物均处于小型 1 期临床试验阶段。MDM2 抑制剂现正进入人类临床试验。
胶质母细胞瘤的其它细胞周期调节剂也在研发中,包括 G2/M 检查点蛋白 Wee1 的抑制剂。抑制 Wee1 可增加细胞对 DNA 损伤(如化疗诱发的 DNA 损伤)的敏感性,尤其在 p53 功能障碍时可导致细胞凋亡,目前口服 Wee1 抑制剂 MK1775 的临床试验已在开展之中。
干细胞理论和治疗
尽管对胶质母细胞瘤增殖的基因突变和生长因子的了解在不断增加,但对肿瘤发生的启动步骤还知之甚少。传统认为,终末分化的胶质细胞在获得一系列突变后,导致脱分化和肿瘤的形成。然而,新的理论假设神经干细胞的某一特殊亚群参与胶质瘤的启动和发展。
干细胞具有三个特性:自我更新、广泛增殖的能力和多向分化潜能。干细胞样癌细胞亦有无限自我更新以及维持异质性肿瘤的能力。目前已有一些胶质母细胞瘤干细胞样细胞的生物标记物,包括造血干细胞标记物 CD133,但尚无单个标记物与肿瘤完全相关。
在表现型上,胶质母细胞瘤干细胞样细胞可形成悬浮球,称为神经球。干细胞样癌细胞可成为静止细胞,仅在肿瘤减小或需要干细胞增殖时才进入细胞周期。在静止期时,干细胞样癌细胞可避开具有细胞毒性的化疗和放疗的作用,因为放化疗主要针对的是快速分裂的细胞。
此外,干细胞样癌细胞还可表现出抗药性,如表达 ATP 结合盒基因家族的多功能转运蛋白。
胚胎信号通路也参与干细胞样状态的维持和脑内微环境的相互作用。因此,以 Notch、Hedgehog、Wnt/β-catenin 等胚胎信号通路位靶点,已成为胶质瘤新兴的治疗方法。
譬如,以 Notch 通路为靶点 的γ- 分泌酶抑制剂。临床前研究提示,Notch 通路的抑制剂可协同放疗,调控干细胞样癌细胞和血管新生。采用γ- 分泌酶抑制剂 RO4929097 联合放疗或贝伐单抗的临床试验已完成,结果正待揭晓。但由于 RO4929097 的药代动力学特征不佳,此药的研发已暂停,但未来的研究正计划选择替代性药物。
免疫治疗
除了细胞信号和生长因子的突变之外,部分胶质母细胞瘤的侵袭性与其可逃逸免疫系统的监控有关(表 2)。介导免疫系统逃逸的两个重要的蛋白为细胞毒性 T 淋巴细胞抗原 4 (Cytotoxic T-Lymphocyte Antigen 4,CTLA-4)和程序性细胞死亡蛋白 1 (programmed cell death 1,PD-1),可调控适应性免疫。
PD-1 与其配体 PD-L1 结合后,下调 T 细胞的活性,对活化的肿瘤特异性 T 细胞的凋亡有增强效应。类似的,CTLA-4 可抑制 T 细胞活性。在黑色素瘤中,单克隆抗体易普利姆玛(Ipilimumab)和 nivolumab 可分别对 CTLA-4 和 PD-1 具有强效抑制作用,未来将检测这两种药物的联合治疗对复发性胶质母细胞瘤的疗效。
表 2. 胶质母细胞瘤的免疫治疗
|
治疗 |
机制 |
|
贝伐单抗(Bevacizumab) |
VEGF单克隆抗体 |
|
西妥昔单抗(Cetuximab) |
EGFR单克隆抗体 |
|
DCVax |
树突状细胞疫苗 |
|
易普利姆玛(Ipilimumab) |
CTLA-4单克隆抗体 |
|
Nivolumab |
PD-1单克隆抗体 |
|
Rindopepimut /CDX110/CellDex |
EGFRvIII肽疫苗 |
正在研发中的胶质母细胞瘤疫苗是增加患者免疫系统活性的另一种方法。与抗感染疫苗相同,肿瘤疫苗可使免疫系统对某一特殊抗原做好准备。正在开发的疫苗有两类:肽疫苗和细胞疫苗。譬如,肽疫苗 Rindopepimut(也称为 CDX-110)的靶点为肿瘤 EGFRvIII 突变,目前正进行随机试验研究。
细胞疫苗依赖于树突状细胞,而树突状细胞参与细胞介导的免疫反应,是重要的抗原呈递细胞。收集患者外周血中的树突状细胞,在体外暴露于手术切除的、自体肿瘤的研磨液(含抗原)中,再注射回患者体内。研究显示出有淋巴细胞干扰素γ产生、CD4 +T 细胞和 CD8 +T 细胞的肿瘤特异性前体细胞频率增加、疫苗接种后 CD4 + 肿瘤特异性 T 细胞增加,说明针对树突状细胞疫苗存在显著的免疫反应。
在一项 2 期试验中,77 名新诊断为胶质母细胞瘤的患者,接受了负载自体肿瘤抗原的树突状细胞疫苗的每周注射,治疗具有耐受性, 70% 的受试者可达 6 个月无恶化生存期。另有报道一项树突状细胞疫苗(DCVax,Northwest Biotherapeutics 公司) 的 1 期和 2 期试验,现正开展随机研究。
胶质母细胞瘤免疫治疗的发展面临着许多挑战,包括因放疗和替莫唑胺、糖皮质激素的免疫抑制作用而导致的淋巴细胞减少,需要进行对症治疗。此外,还需影像学工具明确治疗后肿瘤的进展,以及免疫治疗后炎症反应增加。
化疗技术的进展
过去 30 年间,根据最大疗效和对脑组织的安全性,放疗已有标准剂量和治疗时间,放疗的技术也有了显著进步,包括立体定向技术和调强放疗,可对空间进行精确定位和避开正常脑组织,这些技术的进步为复发性胶质母细胞瘤的再次放射提供了可能。为减少放射性脑坏死和脑水肿的风险,再放射可联合贝伐珠单抗,后者可减少血管渗透性和水肿。
一项研究纳入了 25 名复发性恶性胶质瘤的患者,给予低分次立体定向放疗(30 Gy 分 5 次)联合贝伐珠单抗治疗;胶质母细胞瘤的患者,6 个月无恶化生存期为 65%,平均总生存期为 12 个月。
再放射治疗目前已在随机研究中开展,1 期试验将进一步明确剂量的递增。如何应用放射达到不同的生物学效应,如解决肿瘤乏氧的抗放射性,正在探讨之中,改善的方法包括采用碳离子和质子放疗技术,现在亦在随机试验研究中(http://www.clinicaltrials.gov)。
研发替代性给药方法,透过血脑屏障
治疗胶质母细胞瘤的重要问题就是药物能否透过血脑屏障,一些技术已围绕该问题展开研究。
动脉内应用甘露醇开放血脑屏障在原发性中枢神经系统淋巴瘤已有使用,但该技术因治疗全程需要进行重复性血管造影,而不具有实践操作性。
对流 - 加强给药可通过开颅手术在肿瘤床上放置导管,直接将药物灌注入脑实质内,正压灌注可在组织内产生对流,药物被动扩散。然而该技术难以给予重复的剂量,此外脑内能否达到有效药物浓度也是一大疑问。
小于 100 nm 的纳米粒子可通过对流 - 加强或脑室导管技术直接入脑,在局部进行给药治疗,纳米粒子作为载体可增加传统化疗药物(如替莫唑胺、盐酸多柔比星、盐酸伊立替康和硫酸长春新碱)的生物利用度。纳米技术也可将含氧化铁内核的磁性纳米粒子传递入脑,而此种无药的磁性粒子可在磁场中产生局部高热,导致局部细胞死亡。
在动物实验中,超声是暂时开放血脑屏障相对安全和有效的技术。超声不能穿透颅骨,所以要将超声脉冲导入脑内,需行开颅手术在硬膜外腔植入一个小的传感器;在兔的模型中, Evans 蓝染可见外渗、MRI 可见钆对比增强,说明该技术可开放局部的血脑屏障。关于植入性超声设备的研究已进入人体临床试验阶段。
已知一些病毒可穿越血脑屏障,引起脑炎性感染。目前正在研究溶瘤麻疹病毒治疗胶质瘤,开发出基因工程病毒载体。单纯疱疹病毒经基因工程改造,可将无毒的抗疱疹前药转变成具有细胞毒性的副产物,因此可对肿瘤细胞进入特异性靶向治疗。
已进入临床试验的另一项胶质瘤的研究,采用诱导型腺病毒载体工程,在 veledimex 配体存在时表达白介素 -12,提高免疫功能。Veledimex 是转录因子,为 Rheoswitch Therapeutic System 启动子,可转录 IL-12 靶基因。由于靶基因的表达依赖 Veledimex 的剂量和给予频率,因此可调控 IL-12 的表达(“开”和“关”)。如果该方法被证有效,则该策略可用于治疗其它脑肿瘤。
正在研究中的替代性载体有间质性干细胞、神经干细胞和定向祖细胞系,利用它们对癌细胞的趋化作用传递基因或细胞毒性分子,消灭肿瘤。
先进的临床试验设计
胶 质母细胞瘤的临床试验越来越精细、高端。相关研究旨在明确预测性生物标记物,包括组织学、放射学或血浆标记物。当前实体瘤的临床研究依赖于给药前后的组织 标本,研究有无达到预期目标,观察新药的调控作用。该策略在胶质母细胞的研究中面临诸多挑战,由于肿瘤首次切除和再次切除时,样本常难做冰冻处理因此无法 做石蜡包埋。
然而,神经影像学技术的进步令间接评估胶质母细胞瘤的血管新生(灌注 MRI)和肿瘤代谢(磁共振波谱可根据细胞代谢产物 2- 羟基戊二酸非侵入性检测胶质瘤的 IDH1 突变)成为可能。
虽然其它实体瘤的基因突变试验越来越多,但胶质母细胞瘤除 EGFRvIII 之外,突变的频率较低。最近一项复发性胶质母细胞瘤的临床试验,评价了可作为药物靶点的点突变频率,38% 患者表现出一个突变,多数为 EGFR 突变,但每个突变的总频率较低。该研究表明,基于分子筛选的临床试验需要大量受试者才能完成。
此外,很多实体瘤临床试验的设计都是针对非特异性突变的,肿瘤的组织学表现各型均有。脑肿瘤的临床试验设计也是如此,因为研究者害怕对该患病群体增加额外的毒性。
结论
对 于病史长而治愈希望小的疾病,患者和医师都热衷于尝试新治疗。胶质母细胞瘤的遗传学、分子生物学和免疫学研究急剧增长,对其增殖、血管新生和免疫逃逸机制 的了解也在增多,越来越多的治疗靶点涌现。这些新兴的治疗需要根据患者自身基因突变和蛋白表达而选择治疗人群,随着临床试验的推进、大规模的筛选受试者, 我们很快将明确具有临床意义的治疗。
上一篇:成人肝移植评估:美国肝脏疾病和移植学研究协会 2013 实践指南
下一篇:关于血液的20个冷知识
论坛新帖
频道总排行
医学推广
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)