局灶性节段性肾小球硬化综述
2011-12-26 09:31:12 来源:37度医学网 作者: 评论:0 点击:
局灶性节段性肾小球硬化在 儿童肾病综合征病例中大约占20%,以及在成人这类病例中占40%,估计发病率为7/100万1。在美国,它是导致终末期肾脏病最常见的原发性肾小球疾 病,患病率为4%2。主要特征是进行性肾小球疤痕形成。在病程早期,肾小球硬化既为局灶性(累及少量肾小球)也为节段性(累及一部分肾小球球体)。随着 (疾病)进展,发生更广泛和更全面的肾小球硬化。自从20世纪70年代(进行)该疾病的首批临床-病理研究以来3,由于该疾病的发病率不断升高4、对病因 的了解越来越充分以及识别出足细胞作为主要细胞靶点5,(该疾病受到的)关注不断更新。足细胞基因突变与遗传性局灶性节段性肾小球硬化相关这一发现已推动 了足细胞生物学领域(的进展)并且刺激了新的诊断和治疗(的出现)6。
临床特征
蛋白尿是局灶性节段性肾小球硬化的一个确定特征,通常伴有低蛋白血症、高胆固醇血症和外周水肿。儿童肾病综合征被定义为蛋白尿(每日尿蛋 白>1 g /m2体表面积)、低蛋白血症 (白蛋白<2.5 g /dl)、高胆固醇血症(总胆固醇>200 mg/dl)和水肿。 在成人,肾病综合征被定义为尿蛋白水平> 3.5 g/d和白蛋白水平<3.5 g/dl。大约75%~90%的局灶性节段性肾小球硬化儿童 和50%~60%的局灶性节段性肾小球硬化成人在就诊时有肾病综合征。
局灶性节段性肾小球硬化曾被认为是一种单一疾病,但目前被认为是一组具有共同肾小球病变并且由针对足细胞的或足细胞内固有的各种损伤介导的临床 -病理综合征(表1)。尽管已识别出很多导致局灶性节段性肾小球硬化的因素,但大约 80%的病例为原发性(特发性)。局灶性节段性肾小球硬化和一种相关 疾病(微小病变性疾病)是典型的足细胞疾病或“足细胞病”7,8。在这两种病况中,足细胞损伤均导致足细胞足突(与肾病性蛋白尿相关的主要结构)消失。足 细胞形状的这种改变需要肌动蛋白细胞骨架的重排,用糖皮质激素治疗后,这一过程在微小病变性疾病中通常可逆,但在局灶性节段性肾小球硬化中不可逆并且呈进 行性。

发病机制
滤过屏障的丢失
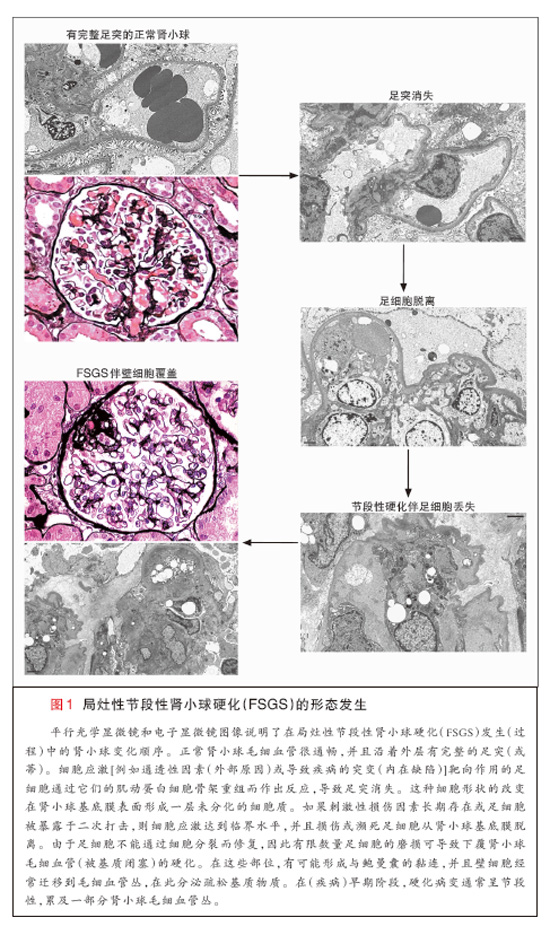
肾病性蛋白尿由肾小球滤过屏障的完整性丧失导致,滤过屏障通过(以下)3层(结构)的紧密联系而调节选择通透性:内层血管界面的有孔肾小球内皮 细胞,中间的肾小球基底膜,以及外层尿路界面的足细胞(也称为脏层上皮细胞)(图1)。足细胞是高度分化的极化上皮细胞,它们的大的细胞体和长的细胞延伸 与神经元相像,通过一个中央肌动蛋白细胞骨架核心(保持)稳定(图2)。足突沿肾小球毛细血管壁外表面犬牙交错,通过裂孔隔膜(以拉链样阵列排列的修饰黏 附连接)连接至它们的相邻结构9。足细胞为肾小球毛细血管提供结构支持,并且合成裂孔隔膜的蛋白和肾小球基底膜的很多胞外基质成分。这些终末分化细胞不能 通过细胞分裂的方式进行修复,(而是)通过脱离、凋亡或坏死的方式使足细胞消耗成为肾小球硬化的一种关键介质8。在过去10年中,足细胞消耗动物模型和人 类疾病遗传研究均带来了(对该疾病的)新见解。
实验性毒素模型中的足细胞消耗
实验模型已解决了将一种致死性毒素特异地和专门地输入足细胞是否足以导致局灶性节段性肾小球硬化(这一问题)。例如,在一种足细胞特异性启动子 控制下表达毒素受体的转基因动物的构建可使毒素只以足细胞为靶点10,11。在这种模型中,白喉毒素或假单胞菌外毒素A的内化可通过抑制蛋白合成而杀死足 细胞。在这些模型中,毒素暴露后的足细胞消耗程度与疾病严重程度密切相关11。足细胞丢失超过40%可导致明显的局灶性节段性肾小球硬化伴高度蛋白尿和肾 功能不全,这提示了疾病(的发生)阈值11。在短暂暴露于毒素后,足细胞(持续)数月脱落至尿中,提示足细胞丢失的继发性自动期12。在一种只有一部分足 细胞表达毒素受体的嵌合模型中,(有人)观察到足细胞损伤和去分化蔓延至邻近逃脱了初始损伤的毒素抵抗足细胞13。这种嵌合模型提示,损伤可通过一种多米 诺样效应在局部从足细胞传播到足细胞,这种效应可解释病变的节段性质。虽然(其中的)介质尚不清楚,但第二波足细胞损伤在理论上有可能减少通过肾病蛋白 (nephrin)和谷氨酸受体进行信号转导的足细胞存活因素14或有可能增加伤害性因素[例如剪应力、血管紧张素Ⅱ或转化生长因子 β(TGFβ)]13。

一种由蒽环类多柔比星(也称为阿霉素)诱导的局灶性节段性肾小球硬化实验模型可在BALB/c小鼠中导致重度疾病,而其他小鼠品系受到保护。这种品系依 赖性一直无法得到解释,直至最近发现了作为Prkdc(蛋白激酶、DNA激活催化多肽)祖先突变的易感性基因,这种基因编码DNA双链断裂-修复机器的成 分15。在BALB/c小鼠中,在多柔比星嵌入足细胞DNA后,没有出现非同源性末端连接DNA修复,导致线粒体DNA消耗15。这种鼠类模型阐明了抗基 因毒性应激的保护机制对延长足细胞寿命的重要性。
遗传易感性
自从1998年发现肾病蛋白是裂孔隔膜的主要成分以来16,在家族性和散发性局灶性节段性肾小球硬化识别出的足细胞突变数量不断增长(图2和补 充附录中的表,其与本文全文均可从NEJM.org获取)。该基因编码位于裂孔隔膜16-19、细胞膜20-24、胞浆25、肌动蛋白细胞骨架 26-29、胞核30,31、线粒体32-34和溶酶体35的多种足细胞产物。肾病蛋白和足突蛋白(podocin)的突变最频繁36。大多数突变发生于 常染色体隐性遗传之后,并且在生命早期表现出来。常染色体显性遗传型(例如α-辅肌动蛋白-4和瞬时受体电位阳离子通道6编码基因的突变)通常存在于青少 年期后期或成年期。(发病)涉及的很多基因通过在受累家族中的定位克隆而被识别,并且后来在整体敲除模型或足细胞特异性敲除模型或在表达突变基因的转基因 模型中得到验证。(有人)在多达2/3于出生后第1年就诊的局灶性节段性肾小球硬化患者中识别出了基因缺陷,这强调了在该年龄组中进行遗传检测的重要性 37。在婴儿、幼儿以及有综合征性疾病或阳性家族史的患者中,基因检测很可能会发现局灶性节段性肾小球硬化的(发病)基础。小(但有临床意义)百分率有散 发性糖皮质激素抵抗疾病的较大龄儿童和成人可能也有突变36。
足细胞基因编码多种参与信号转导事件(调节足细胞生长、分化、运动和细胞之间以及细胞与基质之间相互作用)的结构蛋白或酶38。这些基因产物通 过中间蛋白直接或间接地与肌动蛋白细胞骨架偶联(图2)。这些蛋白的信号转导破坏或失调可导致肌动蛋白细胞骨架的重排和足突消失的全面反应。足细胞是一种 具有机械感受器(可对位置刺激和剪应力作出反应)的运动性细胞39。促进细胞骨架(无论太刚性或太动态)发育的因素均对足细胞的存活构成潜在威胁。例如, 在α-辅肌动蛋白-4中导致疾病的突变通过暴露一个独立于钙调节的掩埋肌动蛋白结合位点而产生一种刚性细胞骨架,从而导致功能的获得40。肌动蛋白细胞骨 架一旦进行重排,足突锚定作用的丧失有可能削弱足细胞对肾小球基底膜的附着,使它们在对滤过压反应时更易发生分离。剪应力所致磨损和撕裂、拉伸张力、氧化 应激和数年来积累的DNA损伤均有可能构成该疾病的遗传基础41。这种累积性二次打击有可能解释了在有常染色体显性突变的成人中遗传性局灶性节段性肾小球 硬化的晚发(原因)。
非洲裔患者的遗传基础
在各个年龄组,黑人的局灶性节段性肾小球硬化发病率均高于白人,并且肾脏存活率均低于白人。在大型人群中通过混合连锁不平衡的方法进行的(基 因)测绘识别出了黑人局灶性节段性肾小球硬化和终末期肾脏病的遗传危险因素。(有人)在人类22号染色体识别出了密切连锁不平衡的两个基因。MYH9(编 码肌球蛋白重链9,后者是一种非肌肉性肌球蛋白ⅡA,是足细胞的细胞骨架的一种成分)首先被识别42,并且是一种吸引人的候选基因,因为已知MYH9突变 在爱泼斯坦-费希纳综合征(肾脏疾病、感觉神经性耳聋和巨血小板减少症)患者中可导致一种罕见的常染色体显性遗传型局灶性节段性肾小球硬化27,43。全 基因组扫描在一种常染色体隐性遗传模型的黑人中识别出MYH9基因内含子23的3种单核苷酸多态性是原发性局灶性节段性肾小球硬化和高血压性终末期肾脏病 的危险(因素)42,44。然而,对基因间距的进一步探测在邻近的载脂蛋白L1(APOL1)编码基因最后1个外显子上发现了2个独立序列变异体(称为 G1和G2),该变异体与局灶性节段性肾小球硬化有较强相关性,其复合信号较MYH9增加35倍。因此,APOL1被认为是实际易感基因45。
在欧洲人和非洲人中(进行)的选择试验显示,APOL1 G1和G2单体型只在非洲处于强选择45。载脂蛋白L1是一种可溶解布氏布锥虫 (Trypanosoma brucei brucei,可导致非洲锥虫病的寄生虫)的血浆因子。可抵抗载脂蛋白L1溶解(作用)的两种锥虫属亚种(布氏 罗得西亚锥虫和布氏冈比亚锥虫)是在撒哈拉以南非洲进化的。APOL1的G1和G2变异体可溶解布氏罗得西亚锥虫但无法溶解布氏冈比亚锥虫,这一结果解释 了这些变异体如何通过自然选择而升至高频率。这种情况类似于镰状细胞(遗传)性状,其血红蛋白A的β链突变赋予(患者)对抗疟疾的保护作用,但有(发生) 血红蛋白病的危险。在这两种情况下,对抗寄生虫感染的保护作用是一种存在于杂合子中的显性性状,而宿主疾病的发生是一种存在于纯合子中的隐性性状。 APOL1 G1和G2变异体如何机械作用于足细胞而导致局灶性节段性肾小球硬化尚无描述。
病理学定义
局灶性节段性肾小球硬化的组织学定义是肾小球毛细血管被细胞外基质节段性闭塞7,46。血浆蛋白被包围成透明变性通常伴有硬化。由于近髓肾单位 往往首先受累,因此需要充分的肾小球取样才能识别出诊断性病变。硬化节段与鲍曼囊之间有可能形成黏附或黏连。在电子显微镜检查时,主要的发现是足突广泛消 失,肾小球基底膜没有其他异常。足细胞从肾小球基底膜脱离发生于硬化病变上覆区。在这些部位,往往存在由移行至(毛细血管)丛的壁细胞合成的疏松基质物质 聚积,从而产生一种晕轮样效应。颗粒状免疫型电子致密沉积物不存在。免疫荧光通常显示被包围于透明变性区的IgM和C3的粗糙节段性染色。随着各个肾单位 退化,发生小管萎缩和间质纤维化。近端小管重吸收微滴反映了白蛋白和脂蛋白的小管运输增加(一种导致进行性小管间质损伤的过程)47。
局灶性节段性肾小球硬化的肾小球病变病理学多样性明显7,46,48。病变部位是在肾小球门(血管极)还是小管极方面在解剖学上存在差异,并且 在肾小球细胞增多还是毛细血管萎限方面在性质上也有差异46。组织学变异体的分类识别出了未另行规定(NOS)46、肾门周围46,49-53、细胞 53,54、顶端46,55,56和萎限性疾病57-62的变异体,并且对原发性和继发性局灶性节段性肾小球硬化均适用(图3)。
在萎限性变异体中,足细胞有一个不成熟的失调节表型63,64。由于受损足细胞丧失了分化标志物(例如肾病蛋白),因此在鲍曼间隙增殖的细胞性 质存在争议。最近使用壁细胞标志物(进行)的研究提示,大多数这些细胞实际上来源于壁层65-67。此外,携带干细胞标志物CD133和CD24的祖细胞 排列于鲍曼囊,可能起到作为补充已丢失足细胞的储备库的作用68。虽然祖细胞有可能被募集到足细胞剥脱的部位,但它们是否可分化为重建正常滤过屏障所需的 成熟足细胞尚不清楚。
相关热词搜索:肾小球硬化
上一篇:2012年NSFC与NIH合作项目指南
下一篇:对疑似甲型H3N2流感病毒感染者进行标本采集、处理与检测的临时指南
论坛新帖
频道总排行
医学推广
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)