生物标志物综述—药物研发的催化剂
2011-05-02 20:20:05 来源: 作者: 评论:0 点击:
疗信息系统,以便于社区肿瘤医生查询。不过目前,有关患者隐私的问题和公众对于遗传检查的担忧还在阻碍着这个 系统的建立,不过,相信研究人员一定能找出解决的办法去应对。
基因组生物标志物足够强大吗?
最初,使用基因组学技术对肿瘤生物学标记方面所进行的研究,都关注于发掘那些具有不同侵袭性的肿瘤组织在基因表达方面的差异情况。目前,研究 人员已发现,这些标志疾病进展的生物学标记在诸如乳腺癌、淋巴瘤乃至其它类型的肿瘤中并非单一分子,而是一系列基因的表达水平都发生上调或者下调的改变, 这种改变与疾病的进展过程相关。
早期以酵母为模式生物所进行的工作,使研究人员掌握了如何利用多基因表达谱——或者叫做基因表达标记以及形态搭配技术(pattern- matching technology)来寻求新的生物学发现。在过去5年内,许多研究小组陆续发现了一些可以预测侵袭性疾病的表达谱改变。出乎人们预料的是,里面的许多 基因表达改变与以往的研究结果相比,仅有很少的部分是一致的,而接下来的研究工作又进一步证实了在早期研究中发现的路径机制的正确性。
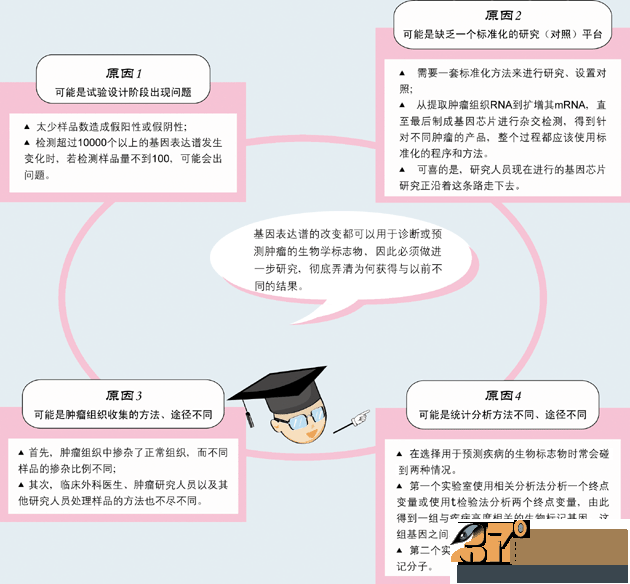
多变量分析法从最有可能的基因(可能就是第一个实验室得到的基因)入手开始研究,然后再加入其它与该基因不同的基因进行研究。在最特殊的情况 下,使用同一组数据,这两种方法得到的基因可能只有一种是共同的。这就会让临床工作者感到困惑,为什么会得到这样的结果呢?最终,尽管临床上的问题可能只 有几个,比如哪一个生物标志物分子能用于预测侵袭性疾病,但实际上,在研究过程中人们选择的方法、实验数据不同,得到的结果(生物标志物分子)就会完全不 同。
有一个很好的例子可以说明这个问题。这是在一家医院对乳腺癌患者进行的一个配对试验研究,该实验是为了研究与乳腺癌病情进展情况相关的生物标 志物。研究人员分别选取了该院55岁以下的患者以及所有合适的患者作为两组试验对象。这两组试验对象得到了完全不同的两组试验结果,这明显和在选择实验对 象时加入了年龄因素有关。
当所有的实验室、研究人员们都使用同样的样品、同样的技术平台以及用同样的标准来选择病人,那么得到的数据就要可靠得多了。虽然在这种情况下还 是会有变量,但这些变量是能够反应实际生物学变化的变量的。在处于生物学标记分子研究的起步阶段时,很重要的一点就是,上面提到的那些影响因素会妨碍研究 人员建立一个能使患者利益最大化的标准。这甚至比研究预测治疗反应性的生物标志物分子本身还要重要。实际上,在研究能用于发现对药物敏感的亚人群的生物标 志物分子方面,研究人员已经获得了一定的进展。这些进展中的一项就是发现了EGFR基因突变是导致患者对EGFR抑制剂敏感或耐受的原因。其它用表达谱分 析法发现的成果包括:发现了对紫杉醇、氟尿嘧啶和其它细胞毒性药物敏感的生物标志物。用同样的方法研究与疾病进展有关的生物标志物分子时也会发现与治疗相 关的生物标志物分子。

他们的这种希望说明,他们完全忘记了在过去30年来研究肿瘤的过程中所经历的种种失败与教训——肿瘤并不像想象的那么简单,相反,它们非常复 杂。不过现在,研究人员有能力面对这种复杂情况了:人们要全面了解每一个生物学标记所代表的含义。如果要做进一步改进,更好地为某一类患者开发出更适合的 药物,那么就需要有一个更大的更富关联性的数据库,该数据库应该包含患者多年的临床资料,同时,还需要基于DNA、RNA和蛋白质的技术平台,只有这样才 能取得成功。

如果单纯地希望能发现一个生物标志物分子就可以预测治疗反应性,这是非常幼稚的。
由此便引出了一个基本问题——需要对各种疾病状态进行检测吗?如果肿瘤有几百个甚至数千个不同的生存环境,那将是多么庞大的一个数据量啊,不过即便如此,也未必完全没有可能。
将生物标志物分子真正应用到临床中,我们准备好了吗?
这将给我们带来许多紧迫的问题和政治上的麻烦。我们已经在各个方面展开了全方位的紧密合作,我们共享技术平台,研究同一个问题。目前学术界、制药企业以及政府组织都准备投入到图1所示的那种循环模式中。
学术界一直都在为获得那些“看不见的”原创性知识产权而激烈竞争,同时也在为获得“看得见的”地位和资金而竞争。制药企业和生物技术企业也在 为他们开发产品所担负的风险,以及是否能获得丰厚回报而竞争。与此相比,在过去的几年间,政府对于他们推动生物标志物的合作研究显得过于乐观了。
我们该何去何从?
我们真的应该好好学习互联网界——依靠学术界、企业界和政府组织间的大协作,才获得了如此成就。
互联网界的成功依赖于他们靠团队合作解决项目难题,同时业界有统一的标准,所有人都在这一标准下进行工作,由这一标准将大家整合起来,同时,该 标准并不是由哪个政府或哪家企业单独制定的。这种大协作对互联网界的重要性从他们制定操作系统标准这件事就可以看出来了。而在我们肿瘤生物标志物界,还有 太多的参与者是研究领域之外的资助者、调整者和患者。当我们要把他们都通通整合起来时,我们是不可能建立一个简单、快速的问题解决模式的,因此我们只能建 立一个长期的新型的合作模式来研究肿瘤生物标志物。
如果不仅仅只是将重心放在设计临床实验以便证明治疗对某个人群具有效益,而是进行相应试验,对已知对治疗有反应的人群在接受治疗后所获得的收 益进行统计学的评价,又会给我们带来怎样新的视角与疾病治疗方式呢?比较可能会出现的情况是,临床医师和(或者)癌症研究中心或治疗中心的研究人员不仅需 要对接受治疗者进行安全性、疗效方面的试验,还需要与肿瘤药物公司的科学家们合作,进行相应试验,并对患者接受治疗前的各项数据进行贮存,这种合作关系即 使在药物已经获得FDA的批准之后还将延续。上述合作可以帮助我们建立一个科学、有事实依据为基础的系统,从而利于为今后接受治疗的患者提供最佳的治疗, 因为在该系统的数据库中已经囊括了所有之前接受过治疗的患者的各项信息。
建立这样一个癌症病人治疗模式可能会使目前学术界、医疗界、制药界和政府间的职能界限变得模糊。通过目前的健康保险便利及责任法案(HIPPA)对患者的隐私进行保护,以及学术界已有的保护知识产权的方案,我们是可以建立这样一个治疗模式的。
这要求生物公司能找出还处于竞争前期的项目参与合作。在癌症治疗中心和政府组织间展开合作是最有可能,同时也是最有效率的合作方式。当然,要实 现该领域的有效合作,我们还需要解决许多问题;但同时我们也应当看到,所有与此相关的研究者们都十分期待合作的开始。食品及药物管理局(FDA)最近所采 取的举措表明,展开全方位合作的时机业已成熟。
2.1癌症生物标志物的开发与应用
三十年来,研究人员一直在寻觅一种有效且对机体无损伤的肿瘤检测方法。终于,在2003年,Cui等人宣称找到了一 种理想的肿瘤检测方法[1]。他们开发了一种基于DNA的血液检测法来评估病人罹患结肠癌(CRC)的风险。Cui的这项研究成果受到肿瘤生物学界密切关 注,因为该成果是肿瘤检测生物标志物应用及开发领域所取得的重大进展。
Cui等人对172例结肠癌病人的组织切片及血液样本进行了研究,分析了这些样本中胰岛素样生长因子II(IGF2)基因的印记缺失(LOI, 见文后小词典)情况。
Cui等人对172例结肠癌病人的组织切片及血液样本进行了研究,分析了这些样本中胰岛素样生长因子II(IGF2)基因的印记缺失(LOI, 见文后小词典)情况。
基因甲基化也可发生于生命晚期。Cui等人证明IGF2基因的印记缺失不仅与CRC家族病史相关,同时也证明与 个人结肠腺癌和CRC病史相关[1]。LOI与家族性CRC之间的关联尤为引人注意,因为多达30%-50%的散发性CRC都具有家族病史,但这其中的遗 传机制目前还不清楚。然而人们目前已经发现了症状明显但是十分罕见的遗传性CRC综合症-家族性结肠腺瘤性息肉病(familial adenomatous polyposis coli)及遗传性非息肉性结肠癌的分子发病机制。
研究人员在28%的具有CRC家族病史的病人体内发现了LOI,而这一数字在具有个人CRC病史的病人中更是高达 56%。与之相反,正常人群中出现LOI的几率不到10%。如果LOI 真是CRC的发病因素之一,那么它与CRC之间的这种关联不仅能够推动基于血液的诊断性生物标志物的开发,同时也加深了我们对于散发性CRC的生物学认 识。
LOI很可能通过甲基化这一表观遗传学现象而与肿瘤的发生相关联。DNA甲基化和DNA突变都能够影响遗传信息在DNA-RNA-功能蛋白质这条途径上的传输。DNA中的胞嘧啶发生甲基化会影响基因的表达。在许多情况下,甲基化会抑制转录过程[2](见图)。
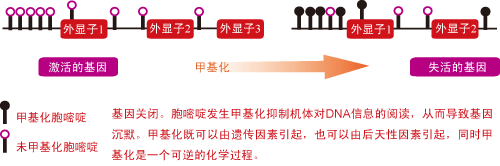

研究人员对甲基化调节这一复杂过程十分感兴趣,因为与DNA突变不同,甲基化过程具有化学可逆性,而且基因的甲基化可能是遗传所致或者由于外界环境所引起。
IGF2是一种重要的肿瘤生长因子,正常情况下,调节IGF2基因表达的DNA序列由于甲基化而被关闭。但是在 LOI存在的情况下,这段DNA序列的甲基化状态发生了改变。在Cui领导的这项研究中,发现LOI可能由于遗传或其它原因在生命早期出现,因为他们在多 份结肠癌组织切片及少量白细胞样本中都发现了这一表观遗传学现象。但若LOI出现于单集落细胞无性繁殖的生命晚期,则说明LOI可能是结肠组织采取的一种 补救措施。
Cui等人开展的这项研究将非损伤性肿瘤检测方法研究又向前推进了一大步,但是该方法是否在临床上也同样有效还需要仔细考虑一下几个因素:
第一, LOI并不能直接代表CRC,而只能提示一种患病趋势。
这种趋势性的间接判断指标单独或与其它标记联合在临床上还是可能有其用武之地,但前提条件是它们要有足够的灵敏度,而且阴性检测结果必须能确定受检者罹患CRC的风险很低,只有做到以上两点,我们才能省略传统的筛查步骤[3]。
鉴定出不需要进行活组织切片检查等传统筛查步骤的人群亚群,是开发肿瘤生物标志物的重要目标之一。开发其它类型的 分子标记的目的并不在于检测一个人一生患腺瘤或CRC的风险和趋势,而是直接判断病人体内是否已经出现肿瘤组织。DNA突变就是这种标记之一,它能够在一 定程度上反映正常结肠组织正在向腺瘤及最后CRC发展的进程[4]。病人的粪便[5,6]和血液都可以作为样品来检测肿瘤内的DNA突变。
基于蛋白质组学的检测方法主要检测肿瘤及与之相关的蛋白产物,从而鉴定一个人是否罹患肿瘤[7]。
目前生物标志物开发的主导方法有两种,但现在还不知道究竟哪一种方法的研究成果能够率先应用于临床实践。Cui采 用的是一种基于假设的方法。在该方法中,首先假设IGF2分子与肿瘤发生相关,从而为研究提供了一个靶标。利用这种假说,便能够对可能的候选基因或蛋白逐 个进行研究。
当然,很可能要整合多种标记才能取得研究最后的成功,因为单一标记无法提供足够的灵敏度和特异性[6]。
任何一种新型标记的研究首先都需要攻克技术难关[5]。因此通常来说,一步一步脚踏实地,在已有的肿瘤生物学知识之上进行研究才是比较合理和有希望取得成果的方式。
另一种称为“基于发现的研究”(discovery-based research)[8]的研究方法也开始逐渐流行起来,这首先要归功于高通量技术的发展,因为该技术能让研究人员同时对成千上万的基因或蛋白进行分析。 基于发现的研究方法不需要事先找到一个靶标。例如,在RNA表达芯片技术的帮助下研究人员可以同时对大部分的基因组进行筛查,从而预测肿瘤患者的预后 [9]。或者研究人员还可以利用质谱技术筛查病人血清全蛋白质组,以判定该患者是否罹患肿瘤[7]。利用新方法我们得到了复杂的基因表达模式或质谱分析曲 线,这些信息可以帮助我们找出一些能够被传统方法用来检测的基因或蛋白质[10]。
与旧方法不同,新的生物标志物研究方法所得到的基因或蛋白质表达模式本身就可以成为一种检测手段,例如“特异性表 达谱”[9]或经过计算分析的蛋白质组模式[7],同时我们并不需要准确知道究竟是哪些基因或蛋白构成了这些模式。这种研究可能最终能为我们提供大量有用 的结果,但这些结果首先必
上一篇:三级综合医院评审标准
下一篇:神经病理性疼痛
论坛新帖
频道总排行
医学推广
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)