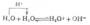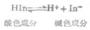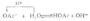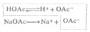氢键
2011-11-30 09:33:11 来源: 作者: 评论:0 点击:
一、氢键的本质
氢原子与电负性很大、半径很小的原子X(F,O,N)以共价键形成强极性键H-X,这个氢原子还可以吸引另一个键上具有孤对电子、电负性大、半径小的原子Y,形成具有X-H…Y形式的物质。这时氢原子与y 原子之间的定向吸引力叫做氢键(以H…Y表示)。
氢键的本质一般认为主要是静电作用。在X-H…Y中,X-H是强极性共价键,由于X的电负性很大,吸引电子能力强,使氢原子变成一个几乎没有电子云的“裸露”的质子而带部分正电荷。它的半径特别小,电场强度很大,又无内层电子,可以允许另一个带有部分负电荷的Y原子(即电负性大,半径小且有孤对电子的原子)充分接近它,从而产生强烈的静电相互作用而形成氢键。
一般分子形成氢键必须具备两个基本条件:
1.分子中必须有一个与电负性很强的元素形成强极性键的氢原子。
2.分子中必须有带孤对电子,电负性大,原子半径小的元素。
氢键常在同类分子或不同类分子之间形成,叫做分子间氢键,如氟化氢、氨水:
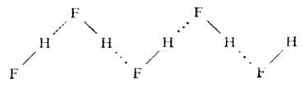
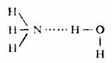
二、氢键的键长和键能
氢键的键长是指X-H…Y中X与Y原子的核间距离。在HF缔合而成的(HF)n缔合分子中,氢键的键长为255pm,而共价键(F-H间)键长为92pm。由此可得出,H…F间的距离为163pm(255-92)。可见氢原子与另一个HF分子中的F原子相距是较远的。
氢键的键能是指被破坏H…Y键所需要的能量。氢键的键能约为15-30kJ.mol-1,比一般化学键的键能小得多,和范德华力的数量级相同。氢键的强弱与X和Y的电负性大小有关。电负性越大,氢键的强弱还和Y的半径大小有关,y 的半径越小,越能接近H-X键,形成的氢键也越强。例如F的电负性最大,半径又小,所以F-H…F是最强的氢键,O-H…O次之,O-H…N又次之,N-H…N更次之。
三、氢键的饱和性和方向性
氢键具有饱和性和方向性。氢键的饱和性表现在X-H只能和一个Y原子相对合。因为H原子体积小,X、Y都比氢大,所以当有另一个Y原子接近他们时,这个Y原子受到X-H…Y上X和Y的排斥力大于受到H原子的吸引力,使得X-H…Y上的氢原子不能再和第二个Y原子结合,这就是氢键的饱和性。
氢键的方向性是指Y原子与X-H形成氢键时,在尽可能的范围内要使氢键的方向与X-H键轴在同一个方向,即以H原子为中心三个原子尽可能在一条直线上。氢原子尽量与Y原子的孤对电子方向一致,这样引力较大;三个原子尽可能在一条直线上,可使X与Y的距离最远,斥力最小,形成的氢键强。
四、氢键对物质性质的影响。
(一)对沸点和熔点的影响
在同类化合物中,能形成分子间氢键的物质,其熔点、沸点要比不能形成分子间氢键的物质的熔点、沸点高些。因为要使固体熔化或液体汽化,不仅要破坏分子间的范德华力,还必须提供额外的能量破坏氢键。H2O,HF,NH3的熔点和沸点比同族同类化合物为高(见表4-3),因为它们都可形成分子间氢键。
表4-3 H2O,HF,NH3及其同族同类化合物的熔、沸点
化合物mp/℃bp/℃化合物mp/℃bp/℃化合物mp/℃bp/℃
H2O0100HF-80.319.5NH3-77.7-33.4
H2S-85.6-60.7HCL-112-84PH3-133.5-87.4
H2Se-64-42HBr-88-67.0AsH3-116-62
H2Te-48-1。8HI-50。9-35.4SbH3-88-17
(二)对溶解度的影响
在极性溶剂中,如果溶质分子和溶剂分子之间可以形成氢键,则溶质的溶解度增大。例如,苯胺和苯酚在水中的溶解度比在硝基苯中的溶解度要大。
氢原子与电负性很大、半径很小的原子X(F,O,N)以共价键形成强极性键H-X,这个氢原子还可以吸引另一个键上具有孤对电子、电负性大、半径小的原子Y,形成具有X-H…Y形式的物质。这时氢原子与y 原子之间的定向吸引力叫做氢键(以H…Y表示)。
氢键的本质一般认为主要是静电作用。在X-H…Y中,X-H是强极性共价键,由于X的电负性很大,吸引电子能力强,使氢原子变成一个几乎没有电子云的“裸露”的质子而带部分正电荷。它的半径特别小,电场强度很大,又无内层电子,可以允许另一个带有部分负电荷的Y原子(即电负性大,半径小且有孤对电子的原子)充分接近它,从而产生强烈的静电相互作用而形成氢键。
一般分子形成氢键必须具备两个基本条件:
1.分子中必须有一个与电负性很强的元素形成强极性键的氢原子。
2.分子中必须有带孤对电子,电负性大,原子半径小的元素。
氢键常在同类分子或不同类分子之间形成,叫做分子间氢键,如氟化氢、氨水:

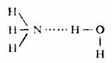
二、氢键的键长和键能
氢键的键长是指X-H…Y中X与Y原子的核间距离。在HF缔合而成的(HF)n缔合分子中,氢键的键长为255pm,而共价键(F-H间)键长为92pm。由此可得出,H…F间的距离为163pm(255-92)。可见氢原子与另一个HF分子中的F原子相距是较远的。
氢键的键能是指被破坏H…Y键所需要的能量。氢键的键能约为15-30kJ.mol-1,比一般化学键的键能小得多,和范德华力的数量级相同。氢键的强弱与X和Y的电负性大小有关。电负性越大,氢键的强弱还和Y的半径大小有关,y 的半径越小,越能接近H-X键,形成的氢键也越强。例如F的电负性最大,半径又小,所以F-H…F是最强的氢键,O-H…O次之,O-H…N又次之,N-H…N更次之。
三、氢键的饱和性和方向性
氢键具有饱和性和方向性。氢键的饱和性表现在X-H只能和一个Y原子相对合。因为H原子体积小,X、Y都比氢大,所以当有另一个Y原子接近他们时,这个Y原子受到X-H…Y上X和Y的排斥力大于受到H原子的吸引力,使得X-H…Y上的氢原子不能再和第二个Y原子结合,这就是氢键的饱和性。
氢键的方向性是指Y原子与X-H形成氢键时,在尽可能的范围内要使氢键的方向与X-H键轴在同一个方向,即以H原子为中心三个原子尽可能在一条直线上。氢原子尽量与Y原子的孤对电子方向一致,这样引力较大;三个原子尽可能在一条直线上,可使X与Y的距离最远,斥力最小,形成的氢键强。
四、氢键对物质性质的影响。
(一)对沸点和熔点的影响
在同类化合物中,能形成分子间氢键的物质,其熔点、沸点要比不能形成分子间氢键的物质的熔点、沸点高些。因为要使固体熔化或液体汽化,不仅要破坏分子间的范德华力,还必须提供额外的能量破坏氢键。H2O,HF,NH3的熔点和沸点比同族同类化合物为高(见表4-3),因为它们都可形成分子间氢键。
表4-3 H2O,HF,NH3及其同族同类化合物的熔、沸点
化合物mp/℃bp/℃化合物mp/℃bp/℃化合物mp/℃bp/℃
H2O0100HF-80.319.5NH3-77.7-33.4
H2S-85.6-60.7HCL-112-84PH3-133.5-87.4
H2Se-64-42HBr-88-67.0AsH3-116-62
H2Te-48-1。8HI-50。9-35.4SbH3-88-17
(二)对溶解度的影响
在极性溶剂中,如果溶质分子和溶剂分子之间可以形成氢键,则溶质的溶解度增大。例如,苯胺和苯酚在水中的溶解度比在硝基苯中的溶解度要大。
相关热词搜索:
论坛新帖
医学推广
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)