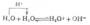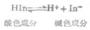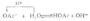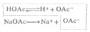电极电位
2011-11-24 10:38:08 来源: 作者: 评论:0 点击:
一、原电池
将锌片插入CuSO4溶液中,锌片上的Zn原子失去电子成为Zn2+而溶解;溶液中的Cu2+得到电子成为金属Cu在锌片上析出,即发生如下的氧化还原反应:
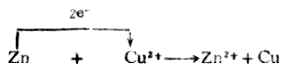
反应中电子从锌原子转移给铜离子。由于锌片和硫酸铜溶液直接接触,溶液中铜离子无秩序地自由运动,使得
Zn和Cu2+之间电子的转移是直接的、无序的,不能定向地形成电流,化学能都以热的形式散失在环境之中。
如果我们采用一个装置(图6-1),使锌原子上的电子不直接转移给铜离子,而是使还原剂Zn失去的电子沿着一条金属导线转移到氧化剂Cu2+上。这样,在导线中就有电流通过。
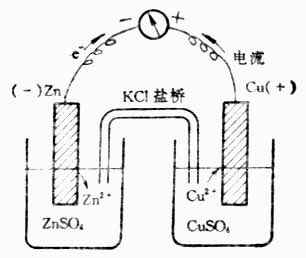
图6-1 铜锌原电池
这个装置是在盛有ZnSO4与CuSO4溶液的烧杯中分别插入锌片和铜片。两个溶液用盐桥相连。盐桥是一支U形管,通常充满用KCL(或KNO3)饱和了的琼脂胶冻。用导线联接两个金属片,并在导线中串联一个灵敏的电流计。通过实验可以看到:
电流计指针发生偏转,说明金属导线上有电流通过。根据指针偏转的方向,可以确定锌片为负极,铜片为正极。
锌片开始溶解,而铜片上有金属铜沉积上去。
取出盐桥,电流计指针回到零点,放入盐桥,电流计指针又偏转。
对上述实验现象可作如下分析:
锌片溶解说明锌片失去电子,成为Zn2+进入溶液。
Zn→Zn2++2e-
电子由锌片经金属导线流向铜片,溶液中Cu2+从铜片上得到电子成为铜原子在铜 片上析出。
Cu2++2e-→Cu
盐桥的沟通电路,使反应顺利进行。因为随着反应的不断进行,在ZnSO4溶液中,Zn2+增多,溶液带正电荷;在CuSO4溶液中,由于Cu2+变为Cu,Cu2+减少,溶液带负电荷。这样将阻碍Zn的继续氧化和Cu2+的继续还原。由于盐桥的存在,其中CL-向ZnSO4溶液扩散,K+则向CuSO4溶液扩散,分别中和过剩的电荷,使两溶液维持电中性,保证了氧化还原反应持续进行。
上述装置中进行的总反应为,
Zn+Cu2+→Zn2++Cu
这一氧化不原反应分两处进行,一处进行氧化,另一处进行还原。即电子不是直接从还原剂转移到氧化剂,而是通过外电路进行传递,电子进行有规则的流动,从而产生电流,实现了由化学能到电能的转变。这种借助于氧化还原反应将化学能转变为电能的装置称为原电池。上述由铜、锌及其对应离子所组成的原电池叫做铜锌原电池。
原电池由两个半电池组成。在鲷铜锌原电池中,锌和锌盐溶液组成一个半电池,铜和铜盐溶液组成另一个半电池。半电池又叫电极。
在原电池中,给出电子的电极为负极,发生氧化反应;接受电子的电极为正极,发生还原反应。在铜锌原电池中,锌半电池为负极,铜半电池为正极。
在负极或正极上进行的氧化或还原半反应叫做电极反应。总反应称为电池反应。铜锌原电池的电极反应和电池反应可分别表示如下:
电极反应负极 Zn→Zn2++2e-
正极 Cu2++2e-→Cu
电池反应Zn+Cu2+→Zn2++Cu
单独表示电极组成时,作为导体的金属通常写在右边。铜锌原电池有两个电极组成式为Zn2+│Zn和Cu2+│Cu。
为了方便,原电池装置可用符号表示。书写电池的惯例如下:
1.一般将负极写在左边,正极写在右边。
2.写出电极的化学组成及物态,气态要注明压力(单位为kPa),溶液要注明浓度。
3.单线 “│ ” 表示极板与电极其余部分的界面。
4.同一相中不同物质之间以及电极中其它相界面均用逗呈“,”分开。
5.双线“‖”表示盐桥。
6.气体或液体不能直接作为电极,必须附以不活泼金属(如铂)作电极板起导体作用。纯气体、液体如H2(g)Br2(l)紧靠电极板。
铜锌原电池的电池表示式为:
(一)Zn│Zn2+(c1)‖ Cu+(c1)│Cu(+)
FeCL3和SnCL2溶液间可发生下面反应:
2FeCl3+SnCl2→2FeCl2+SnCl4
该反应可以组成一个原电池。电极反应和电池反应及电池表示式为:
电极反应 负极Sn2+→Sn4++2e-
正极Fe3++e→Fe2+
电池反应 2Fe3++Sn2+→2Fe2++Sn4+
电池表示式(-)Pt│Sn2+(c1),Sn4+(c2)‖Fe3+(c3),Fe2+(c4)│Pt(+)
上述电池两个电极组成式为Sn4+,Sn2+│Pt和Fe3+,Fe2+│Pt。
二、电极电位的产生
用导线将原电池的两个电极联接起来,其间有电流通过。这表明两个电极之间存在电位差。下面简单介绍金属及其盐溶液之间相界面上电位差是怎样产生的。
金属晶体是由金属原子、金属离子和自由电子组成的。当把金属插入其盐溶液中时,金属表面的离子与溶液中极性水分子相互吸引而发生水化作用。这种水化作用可使金属表面上部分金属离子进入溶液而把电子留在金属表面上,这是金属溶解过程。金属越活泼,溶液越稀,金属溶解的倾向越大。另一方面,溶液中的金属离子有可能碰撞金属表面,从金属表面上得到电子,还原为金属原子沉积在金属表面上。这个过程为金属离子的沉积。金属越不活泼,溶液浓度越大,金属离子沉积的倾向越大。当金属的溶解速度和金属离子的沉积速度相等时,达到了动态平衡。

在一给定浓度的溶液中,若金属失去电子的溶解速度大于金属离子得到 电子的沉积速度,达到平衡时,金属带负电,溶液带正电。溶液中的金属离子并不是均匀分布的,由于静电吸引,较多地集中在金属表面附近的液层中。这样在金属和溶液的界面上形成了双电层(图6-2(a)),产生电位差。反之,如果金属离子的沉积速度大于金属的溶解速度,达到平衡时,金属带正电,溶液带负电。金属和溶液的界面上也形成双电层(图6-2(b)),产生电位差。金属与其盐溶液界面上的电位差称为金属的电极电位,常用符号表示。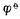
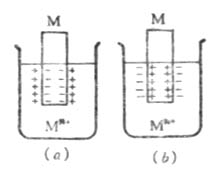
图6-2 双电层
金属与溶液间电位差的大小,取决于金属的性质,溶液中离子的尝试和温度。金属越活泼,电位越低;越不活泼,电位越高。在同一种金属电极中,金属离子浓度越大,电位越高,浓度越小,电位越低。温度越高,电位越高,温度越低,电位越低。
三、电极电位的测定
(一)标准氢电极
电极电位的绝对值是无法测定的,但可以选定一个电极作为标准,将各种待测电极与它相比较,就可得到各种电极的电极电位相对值。国际纯粹和应用化学协会(IUPAC)选定“标准氢电极”作为比较标准。
标准氢电极是氢离子浓度为1mol.L-1氢气的压力为101.325kPa的电极。国际上规定,298K 时,标准氢电极的电极电位为零。用符号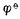 H+/H2=0表示。其电极书写为:
H+/H2=0表示。其电极书写为:
H+(1mol.L-1),H2(101.325kPa)│Pt
标准氢电极的装置如图6-3所示。容器中装有H+浓度为1mol.L-1的硫酸溶液,插入一铂片。为了增大吸附氢气的能力,铂片表面上镀一层疏松的铂(铂黑0。在298k 时,不断从套管的支管中通入压力为101.325 kPa的纯氢气,H2被铂黑吸附直到饱和.这时整个铂黑片仿佛是由氢气组成,铂黑吸咐的H2和溶液中的H+构成了氢电极,其电极反应为;

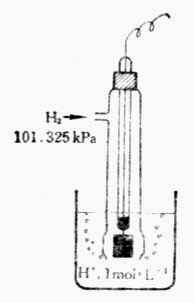
图6-3 标准氢气电极
(二)标准电极电位的测定
参与电极反应的各有关物质均为标准状态(离子浓度为1mol.L-1,气体物质的分压为101.325 kPa)时,其电极电位称为该 电极的标准电极电位,用符号表示。欲测定某标准电极的电位,可将该电极与标准氢电极组成原电池,书写时把标准氢电极列于左侧(假定为负极),将待测电极列于右侧(假定为正极)。用电位计测定该原电池的标准电动势 E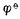 φ,则有
φ,则有
Eφ=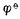 右-
右-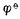 左=
左=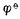 侍测-
侍测-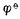 H+/H2
H+/H2
例2测定Zn 2+│Zn电极的标准电位,Zn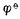 2+/Zn。
2+/Zn。
解:将标准Zn2+│Zn电极与标准氢电极组成原电池。
Pt│H2(101.325kPa),H+(1mol.L-1)‖Zn2+(1mol.L-1)│Zn
298K时,测得Eφ=-0.7628(V)。
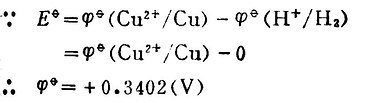
因为Zn 2+│Zn电极的电位为负值,低于标准氢电极的电位。所以Zn 2+│Zn是极为负极,标准氢电极为正极。其电极反应和电池反应为:
电极反应 负极Zn→Zn 2++2e-
正极2H++2e-→H2
电池反应 Zn+2H+→Zn 2++H2

例3 测定Cu2+│Cu电极的标准电极电位, Cu 2+/Cu。
2+/Cu。
解:将标准Cu2+│Cu电极与标准氢电极组成原电池。
Pt│H2(101.325kPa),H+(1mol.L-1)‖Cu2+(1mol.L-1)│Cu
298K时,测得Eφ=+0.3402(V)。
因为Cu2+│Cu电极的电位为正值,高于标准氢电极的电位。所以Cu2+│Cu电极,标准氢电极为负极。其电极反应和电池反应为,
电极反应 负极H2→2H++2e-
正极Cu2++2e-→Cu
电池反应 H2+Cu2+→2H++Cu
(三)标准电极电位表
用上述方法不仅可以测定金属的标准电极电位,也可测定非金属离子和气体的标准电极电位。对于某些与水剧烈反应而不能直接测定的电极,可以通过热力学数据用间接的方法计算出标准电极电位。表6-1列出了298k 时,一些物质在水溶液中的标准电极电位。
为了正确使用标准电极电位表,将有关问题概述如下:
1.在电极反应式氧化型 还原型中,ne表示电极反应的电子数。氧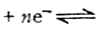
化型和还原型包括电极反应所需的H+,OH-,H2O等物质,如
氧化型与还原型是相互依存的。同一种物质在某一电对中是氧化型,在另一电对中也可以是还原型。例如,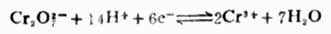
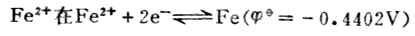
中是氧化型,在
(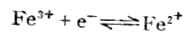 =0.77V)
=0.77V)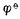
中是还原型。所以在讨论与Fe2+有关的氧化还原反应时,若Fe2+是作为还原剂而被氧化为Fe3+,则必须用与还原型的Fe2+相对应的电对的 值(0.77V)。反之,若Fe2+是作为氧化剂而被还原为Fe,则必须用与氧化型的Fe2+相对应的电对的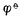 值(-0.88V)。
值(-0.88V)。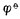
2.表6-1采用的电位是还原电位。不论电极进行氧化或还原反应,电极电位符号不改变。例如,不管电极反应是Zn→Zn2++2e-还是Zn2++2e-→Zn,Zn2+ │Zn电极标准电极电位值均取-0.7628V。
愈高,表示该电对的氧化型愈容易接受电子,氧化其它物质的能力愈强,它本身易被还原,是一个强氧化剂,而它的还原能力愈弱; 愈低,表示该电对的还原型愈容易放出电子,还原其它物质的能力愈强,它本身易被氧化,是一个强还原剂,而它的氧化型的氧化能力愈弱。
愈低,表示该电对的还原型愈容易放出电子,还原其它物质的能力愈强,它本身易被氧化,是一个强还原剂,而它的氧化型的氧化能力愈弱。
电极反应式左方的氧化型可作氧化剂,右方的还原型可作还原剂。氧化型在表的愈下方就是愈强的氧化剂;还原型在表的愈上方就是愈强的还原剂。因此,在不同的氧化剂或在不同的还原剂之间进行强弱比较时,根据标准电极电位的数值可以明确地判断它们的强弱。例如,在表上所列的各物质中,F2是最强的氧化剂,k 是最强的还原剂。
4.标准电极电位 值与电极反应中物质的计量系数无关。例如,Ag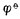 +│Ag电极的电极反应写成,若写成。?(Ag
+│Ag电极的电极反应写成,若写成。?(Ag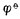 +/Ag)仍是+0.7996V,而不是2*0.7996V.
+/Ag)仍是+0.7996V,而不是2*0.7996V.
5.电极电位和标准电极电位,都是电极处于平衡状态时表现时出来的特征,它和达到平衡的快慢无关。
根据上面所述,在标准状态下,由任何两个电极(半电极)组成电池时,电极电位较高的一方,由于有较强的氧化剂,起还原作用为正极;电极电位较低的一方,由于有较强的还原剂,起氧化作用为负极。
四、影响电极电位的因素
(一)能斯特(Nernst)方程式
一个电极的电极电位的大小与温度、浓度间的关系可用能斯特方程式表示:
(6-2)
式中——电极电位,单位为V
——标准电极电位,单位为V
R——气体常数,8.314J-1.Kmol-1
F——法拉弟常数,96490C.mol-1
T——绝对温度,K
n——电极反应得失的电子数
当温度为298K时,将各常数值代入式(6-2),并将自然对数转换成常用对数,能斯特方程式可改写为:
(6-3)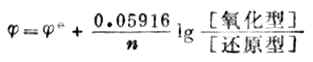
应用能斯特方程式时,应注意以下几点:
1.若电极反应式中有纯固体、纯液体或介质水时,它们的浓度不列入方程式中;气体物质用分压,即101.325kPa的倍数表示。
2.若电极反应式中氧化型、还原型物质前的系数不等于1时,则在方程式中它们的浓度项应以对应的系数为指数。
3. 氧化型、还原型物质包括与它们同存在的有关物质。例如, ,[氧化型]=[MnO4-][H+]8。
(二)有关能斯特方程式的计算
1.计算电极电位
利用能斯特方程式,可以计算不同条件下的电极电位值。
例4 计算298K,锌离子浓度为0.01mol.L-1时,Zn2+│Zn电极的电极电位。
解:电极反应
已知n=2,[Zn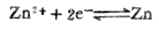 2+]=0.01mol.L-1, (Zn
2+]=0.01mol.L-1, (Zn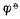 2+/Zn)=-0.7628V,则,
2+/Zn)=-0.7628V,则,
=-0.7628-0.05916
=-0.822(V)
在此例中,由于[Zn2+]<1mol.L-1,所以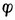 。若金属离子浓度愈小,则金属的电极电位愈低表明还原剂失电子的倾向增强了。
。若金属离子浓度愈小,则金属的电极电位愈低表明还原剂失电子的倾向增强了。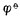
例5 计算298K时,Pt│Fe3+(mol.L-1),Fe2+(0.001mol.L-1)电极的电极电位。
解: 电极反应:
已知n=1,[Fe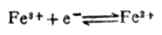 3+]=1mol.L-1,[Fe2+]=0.0001mol.L-1,(Fe3+/Fe2+)=0.77V,则
3+]=1mol.L-1,[Fe2+]=0.0001mol.L-1,(Fe3+/Fe2+)=0.77V,则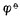
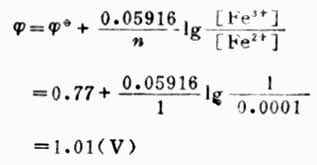
从本例中可以看出,氧化型离子浓度愈大,或还原型离子愈小,电极电位愈高,表明氧化型得电子的倾向愈大。也就是说电极电位随着氧化型物质浓度增大而升高,随着还原型物质浓度增大而降低。
例6 求电极反应
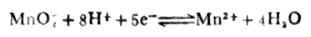
在pH=5溶液中的电极电位(其他条件同标准状态)。
解:已知n=5,[MnO4+-]=[Mn2+]=1mol.L-1,[H+]=10-5mol.L-1,(MnO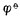 4-/Mn2+)=+1.491V,则
4-/Mn2+)=+1.491V,则

计算结果表明,[H+]降低,对应的氧化型物质(MnO4-)的氧化能力降低。
2.判断原电池的正、负极,计算电动势
通常组成原电池的各有关物质并不是处于标准状态。计算原电池的电动势,首先根据标准电极电位表,利用能斯特方程计算出标准状态下各电极的电极电位。然后根据电极电位的高低判断正、负极,把电极电位高的电极作正极,电极电位低的电极作负极。正极的电极电位减去负极的电极电位即得原电池的电动势。
例7 计算298K时,电池Cu│Cu2+(0.1mol.L-1)‖Fe2+(0.1mol.L-1);Pt的电动势,并说明它是否按惯例书写正负极,列出电池反应式。
解:从表6-1中查出电极反应式及标准电极电位:
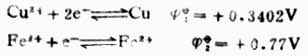
根据能斯特方程式,分别计算它们在非标准状态下的电极电位。

计算结果表明,电池右侧是正极,左侧是负极。该原电池是按惯例书写的。原电池的电动势为:
E= 右-
右-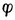 左=0.83-0.31=0.52(V)
左=0.83-0.31=0.52(V)
电极反应 负极 Cu→Cu2++2e-(氧化反应)
正极 Fe3++e- →Fe2+(还原反应)
电池反应 Cu+2Fe3+→Cu2++2Fe2+
例8 计算298K时,电池Pt│I2,I-(0.1mol.L-1)‖MnO4-(0.1mol.L-1),Mn2+(0.1mol.L-1),H+(0.01mol.L-1)│Pt的电动势并写出电池反应式。
解:由表6-1中查出电极反应式及标准电极电位:
根据能斯特方程式,分别计算非标准状态下的电极电位。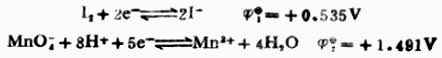

计算表明,电池右侧电极的电极电位高为正极,左侧电极电位低为负极。所以,
E= 右-
右-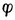 左=1.195-0.594
左=1.195-0.594
=0.601(V)
电极反应 2I-→I2+2e- (氧化反应)
正极MnO-4+8H+ +5e-→Mn2++4H2o (还原反应)
电池反应 2MnO-4+10I-+16H+ →2Mn2++5I2+8H2O
将锌片插入CuSO4溶液中,锌片上的Zn原子失去电子成为Zn2+而溶解;溶液中的Cu2+得到电子成为金属Cu在锌片上析出,即发生如下的氧化还原反应:
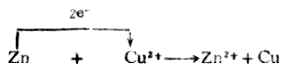
反应中电子从锌原子转移给铜离子。由于锌片和硫酸铜溶液直接接触,溶液中铜离子无秩序地自由运动,使得
Zn和Cu2+之间电子的转移是直接的、无序的,不能定向地形成电流,化学能都以热的形式散失在环境之中。
如果我们采用一个装置(图6-1),使锌原子上的电子不直接转移给铜离子,而是使还原剂Zn失去的电子沿着一条金属导线转移到氧化剂Cu2+上。这样,在导线中就有电流通过。

图6-1 铜锌原电池
这个装置是在盛有ZnSO4与CuSO4溶液的烧杯中分别插入锌片和铜片。两个溶液用盐桥相连。盐桥是一支U形管,通常充满用KCL(或KNO3)饱和了的琼脂胶冻。用导线联接两个金属片,并在导线中串联一个灵敏的电流计。通过实验可以看到:
电流计指针发生偏转,说明金属导线上有电流通过。根据指针偏转的方向,可以确定锌片为负极,铜片为正极。
锌片开始溶解,而铜片上有金属铜沉积上去。
取出盐桥,电流计指针回到零点,放入盐桥,电流计指针又偏转。
对上述实验现象可作如下分析:
锌片溶解说明锌片失去电子,成为Zn2+进入溶液。
Zn→Zn2++2e-
电子由锌片经金属导线流向铜片,溶液中Cu2+从铜片上得到电子成为铜原子在铜 片上析出。
Cu2++2e-→Cu
盐桥的沟通电路,使反应顺利进行。因为随着反应的不断进行,在ZnSO4溶液中,Zn2+增多,溶液带正电荷;在CuSO4溶液中,由于Cu2+变为Cu,Cu2+减少,溶液带负电荷。这样将阻碍Zn的继续氧化和Cu2+的继续还原。由于盐桥的存在,其中CL-向ZnSO4溶液扩散,K+则向CuSO4溶液扩散,分别中和过剩的电荷,使两溶液维持电中性,保证了氧化还原反应持续进行。
上述装置中进行的总反应为,
Zn+Cu2+→Zn2++Cu
这一氧化不原反应分两处进行,一处进行氧化,另一处进行还原。即电子不是直接从还原剂转移到氧化剂,而是通过外电路进行传递,电子进行有规则的流动,从而产生电流,实现了由化学能到电能的转变。这种借助于氧化还原反应将化学能转变为电能的装置称为原电池。上述由铜、锌及其对应离子所组成的原电池叫做铜锌原电池。
原电池由两个半电池组成。在鲷铜锌原电池中,锌和锌盐溶液组成一个半电池,铜和铜盐溶液组成另一个半电池。半电池又叫电极。
在原电池中,给出电子的电极为负极,发生氧化反应;接受电子的电极为正极,发生还原反应。在铜锌原电池中,锌半电池为负极,铜半电池为正极。
在负极或正极上进行的氧化或还原半反应叫做电极反应。总反应称为电池反应。铜锌原电池的电极反应和电池反应可分别表示如下:
电极反应负极 Zn→Zn2++2e-
正极 Cu2++2e-→Cu
电池反应Zn+Cu2+→Zn2++Cu
单独表示电极组成时,作为导体的金属通常写在右边。铜锌原电池有两个电极组成式为Zn2+│Zn和Cu2+│Cu。
为了方便,原电池装置可用符号表示。书写电池的惯例如下:
1.一般将负极写在左边,正极写在右边。
2.写出电极的化学组成及物态,气态要注明压力(单位为kPa),溶液要注明浓度。
3.单线 “│ ” 表示极板与电极其余部分的界面。
4.同一相中不同物质之间以及电极中其它相界面均用逗呈“,”分开。
5.双线“‖”表示盐桥。
6.气体或液体不能直接作为电极,必须附以不活泼金属(如铂)作电极板起导体作用。纯气体、液体如H2(g)Br2(l)紧靠电极板。
铜锌原电池的电池表示式为:
(一)Zn│Zn2+(c1)‖ Cu+(c1)│Cu(+)
FeCL3和SnCL2溶液间可发生下面反应:
2FeCl3+SnCl2→2FeCl2+SnCl4
该反应可以组成一个原电池。电极反应和电池反应及电池表示式为:
电极反应 负极Sn2+→Sn4++2e-
正极Fe3++e→Fe2+
电池反应 2Fe3++Sn2+→2Fe2++Sn4+
电池表示式(-)Pt│Sn2+(c1),Sn4+(c2)‖Fe3+(c3),Fe2+(c4)│Pt(+)
上述电池两个电极组成式为Sn4+,Sn2+│Pt和Fe3+,Fe2+│Pt。
二、电极电位的产生
用导线将原电池的两个电极联接起来,其间有电流通过。这表明两个电极之间存在电位差。下面简单介绍金属及其盐溶液之间相界面上电位差是怎样产生的。
金属晶体是由金属原子、金属离子和自由电子组成的。当把金属插入其盐溶液中时,金属表面的离子与溶液中极性水分子相互吸引而发生水化作用。这种水化作用可使金属表面上部分金属离子进入溶液而把电子留在金属表面上,这是金属溶解过程。金属越活泼,溶液越稀,金属溶解的倾向越大。另一方面,溶液中的金属离子有可能碰撞金属表面,从金属表面上得到电子,还原为金属原子沉积在金属表面上。这个过程为金属离子的沉积。金属越不活泼,溶液浓度越大,金属离子沉积的倾向越大。当金属的溶解速度和金属离子的沉积速度相等时,达到了动态平衡。

在一给定浓度的溶液中,若金属失去电子的溶解速度大于金属离子得到 电子的沉积速度,达到平衡时,金属带负电,溶液带正电。溶液中的金属离子并不是均匀分布的,由于静电吸引,较多地集中在金属表面附近的液层中。这样在金属和溶液的界面上形成了双电层(图6-2(a)),产生电位差。反之,如果金属离子的沉积速度大于金属的溶解速度,达到平衡时,金属带正电,溶液带负电。金属和溶液的界面上也形成双电层(图6-2(b)),产生电位差。金属与其盐溶液界面上的电位差称为金属的电极电位,常用符号表示。

图6-2 双电层
金属与溶液间电位差的大小,取决于金属的性质,溶液中离子的尝试和温度。金属越活泼,电位越低;越不活泼,电位越高。在同一种金属电极中,金属离子浓度越大,电位越高,浓度越小,电位越低。温度越高,电位越高,温度越低,电位越低。
三、电极电位的测定
(一)标准氢电极
电极电位的绝对值是无法测定的,但可以选定一个电极作为标准,将各种待测电极与它相比较,就可得到各种电极的电极电位相对值。国际纯粹和应用化学协会(IUPAC)选定“标准氢电极”作为比较标准。
标准氢电极是氢离子浓度为1mol.L-1氢气的压力为101.325kPa的电极。国际上规定,298K 时,标准氢电极的电极电位为零。用符号
 H+/H2=0表示。其电极书写为:
H+/H2=0表示。其电极书写为:H+(1mol.L-1),H2(101.325kPa)│Pt
标准氢电极的装置如图6-3所示。容器中装有H+浓度为1mol.L-1的硫酸溶液,插入一铂片。为了增大吸附氢气的能力,铂片表面上镀一层疏松的铂(铂黑0。在298k 时,不断从套管的支管中通入压力为101.325 kPa的纯氢气,H2被铂黑吸附直到饱和.这时整个铂黑片仿佛是由氢气组成,铂黑吸咐的H2和溶液中的H+构成了氢电极,其电极反应为;


图6-3 标准氢气电极
(二)标准电极电位的测定
参与电极反应的各有关物质均为标准状态(离子浓度为1mol.L-1,气体物质的分压为101.325 kPa)时,其电极电位称为该 电极的标准电极电位,用符号表示。欲测定某标准电极的电位,可将该电极与标准氢电极组成原电池,书写时把标准氢电极列于左侧(假定为负极),将待测电极列于右侧(假定为正极)。用电位计测定该原电池的标准电动势 E
 φ,则有
φ,则有Eφ=
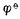 右-
右-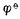 左=
左=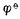 侍测-
侍测-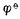 H+/H2
H+/H2例2测定Zn 2+│Zn电极的标准电位,Zn
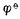 2+/Zn。
2+/Zn。解:将标准Zn2+│Zn电极与标准氢电极组成原电池。
Pt│H2(101.325kPa),H+(1mol.L-1)‖Zn2+(1mol.L-1)│Zn
298K时,测得Eφ=-0.7628(V)。
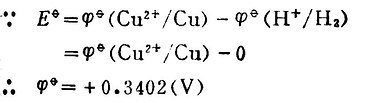
因为Zn 2+│Zn电极的电位为负值,低于标准氢电极的电位。所以Zn 2+│Zn是极为负极,标准氢电极为正极。其电极反应和电池反应为:
电极反应 负极Zn→Zn 2++2e-
正极2H++2e-→H2
电池反应 Zn+2H+→Zn 2++H2

例3 测定Cu2+│Cu电极的标准电极电位, Cu
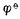 2+/Cu。
2+/Cu。解:将标准Cu2+│Cu电极与标准氢电极组成原电池。
Pt│H2(101.325kPa),H+(1mol.L-1)‖Cu2+(1mol.L-1)│Cu
298K时,测得Eφ=+0.3402(V)。
因为Cu2+│Cu电极的电位为正值,高于标准氢电极的电位。所以Cu2+│Cu电极,标准氢电极为负极。其电极反应和电池反应为,
电极反应 负极H2→2H++2e-
正极Cu2++2e-→Cu
电池反应 H2+Cu2+→2H++Cu
(三)标准电极电位表
用上述方法不仅可以测定金属的标准电极电位,也可测定非金属离子和气体的标准电极电位。对于某些与水剧烈反应而不能直接测定的电极,可以通过热力学数据用间接的方法计算出标准电极电位。表6-1列出了298k 时,一些物质在水溶液中的标准电极电位。
为了正确使用标准电极电位表,将有关问题概述如下:
1.在电极反应式氧化型 还原型中,ne表示电极反应的电子数。氧
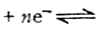
化型和还原型包括电极反应所需的H+,OH-,H2O等物质,如
氧化型与还原型是相互依存的。同一种物质在某一电对中是氧化型,在另一电对中也可以是还原型。例如,
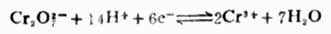
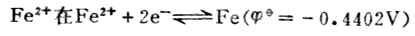
中是氧化型,在
(
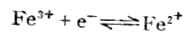 =0.77V)
=0.77V)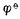
中是还原型。所以在讨论与Fe2+有关的氧化还原反应时,若Fe2+是作为还原剂而被氧化为Fe3+,则必须用与还原型的Fe2+相对应的电对的 值(0.77V)。反之,若Fe2+是作为氧化剂而被还原为Fe,则必须用与氧化型的Fe2+相对应的电对的
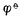 值(-0.88V)。
值(-0.88V)。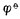
2.表6-1采用的电位是还原电位。不论电极进行氧化或还原反应,电极电位符号不改变。例如,不管电极反应是Zn→Zn2++2e-还是Zn2++2e-→Zn,Zn2+ │Zn电极标准电极电位值均取-0.7628V。

愈高,表示该电对的氧化型愈容易接受电子,氧化其它物质的能力愈强,它本身易被还原,是一个强氧化剂,而它的还原能力愈弱;
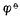 愈低,表示该电对的还原型愈容易放出电子,还原其它物质的能力愈强,它本身易被氧化,是一个强还原剂,而它的氧化型的氧化能力愈弱。
愈低,表示该电对的还原型愈容易放出电子,还原其它物质的能力愈强,它本身易被氧化,是一个强还原剂,而它的氧化型的氧化能力愈弱。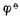
电极反应式左方的氧化型可作氧化剂,右方的还原型可作还原剂。氧化型在表的愈下方就是愈强的氧化剂;还原型在表的愈上方就是愈强的还原剂。因此,在不同的氧化剂或在不同的还原剂之间进行强弱比较时,根据标准电极电位的数值可以明确地判断它们的强弱。例如,在表上所列的各物质中,F2是最强的氧化剂,k 是最强的还原剂。
4.标准电极电位 值与电极反应中物质的计量系数无关。例如,Ag
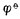 +│Ag电极的电极反应写成,若写成。?(Ag
+│Ag电极的电极反应写成,若写成。?(Ag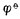 +/Ag)仍是+0.7996V,而不是2*0.7996V.
+/Ag)仍是+0.7996V,而不是2*0.7996V.5.电极电位和标准电极电位,都是电极处于平衡状态时表现时出来的特征,它和达到平衡的快慢无关。
根据上面所述,在标准状态下,由任何两个电极(半电极)组成电池时,电极电位较高的一方,由于有较强的氧化剂,起还原作用为正极;电极电位较低的一方,由于有较强的还原剂,起氧化作用为负极。
四、影响电极电位的因素
(一)能斯特(Nernst)方程式
一个电极的电极电位的大小与温度、浓度间的关系可用能斯特方程式表示:
(6-2)

式中——电极电位,单位为V

——标准电极电位,单位为V

R——气体常数,8.314J-1.Kmol-1
F——法拉弟常数,96490C.mol-1
T——绝对温度,K
n——电极反应得失的电子数
当温度为298K时,将各常数值代入式(6-2),并将自然对数转换成常用对数,能斯特方程式可改写为:
(6-3)
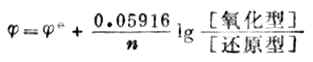
应用能斯特方程式时,应注意以下几点:
1.若电极反应式中有纯固体、纯液体或介质水时,它们的浓度不列入方程式中;气体物质用分压,即101.325kPa的倍数表示。
2.若电极反应式中氧化型、还原型物质前的系数不等于1时,则在方程式中它们的浓度项应以对应的系数为指数。
3. 氧化型、还原型物质包括与它们同存在的有关物质。例如, ,[氧化型]=[MnO4-][H+]8。
(二)有关能斯特方程式的计算
1.计算电极电位
利用能斯特方程式,可以计算不同条件下的电极电位值。
例4 计算298K,锌离子浓度为0.01mol.L-1时,Zn2+│Zn电极的电极电位。
解:电极反应
已知n=2,[Zn
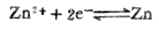 2+]=0.01mol.L-1, (Zn
2+]=0.01mol.L-1, (Zn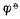 2+/Zn)=-0.7628V,则,
2+/Zn)=-0.7628V,则, =-0.7628-0.05916

=-0.822(V)
在此例中,由于[Zn2+]<1mol.L-1,所以
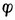 。若金属离子浓度愈小,则金属的电极电位愈低表明还原剂失电子的倾向增强了。
。若金属离子浓度愈小,则金属的电极电位愈低表明还原剂失电子的倾向增强了。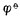
例5 计算298K时,Pt│Fe3+(mol.L-1),Fe2+(0.001mol.L-1)电极的电极电位。
解: 电极反应:
已知n=1,[Fe
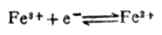 3+]=1mol.L-1,[Fe2+]=0.0001mol.L-1,(Fe3+/Fe2+)=0.77V,则
3+]=1mol.L-1,[Fe2+]=0.0001mol.L-1,(Fe3+/Fe2+)=0.77V,则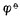
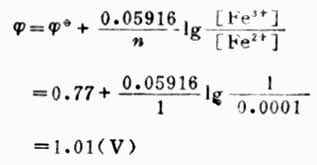
从本例中可以看出,氧化型离子浓度愈大,或还原型离子愈小,电极电位愈高,表明氧化型得电子的倾向愈大。也就是说电极电位随着氧化型物质浓度增大而升高,随着还原型物质浓度增大而降低。
例6 求电极反应
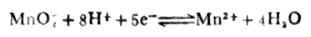
在pH=5溶液中的电极电位(其他条件同标准状态)。
解:已知n=5,[MnO4+-]=[Mn2+]=1mol.L-1,[H+]=10-5mol.L-1,(MnO
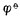 4-/Mn2+)=+1.491V,则
4-/Mn2+)=+1.491V,则
计算结果表明,[H+]降低,对应的氧化型物质(MnO4-)的氧化能力降低。
2.判断原电池的正、负极,计算电动势
通常组成原电池的各有关物质并不是处于标准状态。计算原电池的电动势,首先根据标准电极电位表,利用能斯特方程计算出标准状态下各电极的电极电位。然后根据电极电位的高低判断正、负极,把电极电位高的电极作正极,电极电位低的电极作负极。正极的电极电位减去负极的电极电位即得原电池的电动势。
例7 计算298K时,电池Cu│Cu2+(0.1mol.L-1)‖Fe2+(0.1mol.L-1);Pt的电动势,并说明它是否按惯例书写正负极,列出电池反应式。
解:从表6-1中查出电极反应式及标准电极电位:
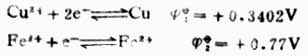
根据能斯特方程式,分别计算它们在非标准状态下的电极电位。

计算结果表明,电池右侧是正极,左侧是负极。该原电池是按惯例书写的。原电池的电动势为:
E=
 右-
右-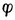 左=0.83-0.31=0.52(V)
左=0.83-0.31=0.52(V) 电极反应 负极 Cu→Cu2++2e-(氧化反应)
正极 Fe3++e- →Fe2+(还原反应)
电池反应 Cu+2Fe3+→Cu2++2Fe2+
例8 计算298K时,电池Pt│I2,I-(0.1mol.L-1)‖MnO4-(0.1mol.L-1),Mn2+(0.1mol.L-1),H+(0.01mol.L-1)│Pt的电动势并写出电池反应式。
解:由表6-1中查出电极反应式及标准电极电位:
根据能斯特方程式,分别计算非标准状态下的电极电位。
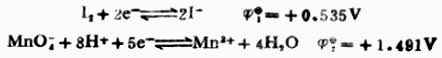

计算表明,电池右侧电极的电极电位高为正极,左侧电极电位低为负极。所以,
E=
 右-
右-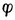 左=1.195-0.594
左=1.195-0.594=0.601(V)
电极反应 2I-→I2+2e- (氧化反应)
正极MnO-4+8H+ +5e-→Mn2++4H2o (还原反应)
电池反应 2MnO-4+10I-+16H+ →2Mn2++5I2+8H2O
相关热词搜索:
论坛新帖
医学推广
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)