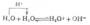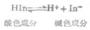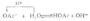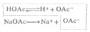氧化还原滴定法
2011-11-24 10:37:39 来源: 作者: 评论:0 点击:
一、概述
氧化还原滴定法是以氧化还原反应为基础的滴定分析方法。氧化还原反应较为复杂,一般反应速度较慢,副反应较多,所以并不是所有的氧化还原反应都能用于滴定反应,应该符合滴定分析的一般要求,即反应完全,反应速度快;无副反应等。因此,必须根据具体情况,创造适宜的反应条件。
(1)根据平衡常数的大小判断反应进行程度。一般K≥106或时,该反应进行得完全。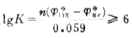
(2)反应速度快。一般可通过下列几种方法增加反应速度。
①加催化剂。例如,用MnO-4氧化Fe2+时,加入少许Mn2+作为催化剂,可使反应迅速进行。
②升高温度。例如,用MnO-4氧化C2O2-4时,室温下反应进行得很慢,温度升高到80℃时反应能够很快地进行。
(3)无副反应。若用于滴定分析的氧化还原反应伴有副反应发生,必须设法消除。如果没有抑制副反应的方法,反应就不能用于滴定。
按照氧化还原滴定中所用氧化剂的不同,将氧化还原法分为高锰酸钾法、碘量法、重铬酸钾法等。本节主要讨论高锰酸钾法和碘量法。
二、高锰酸钾法
(一)基本原理
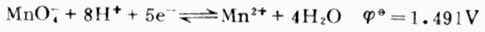
在微酸、中性或弱碱性溶液中,MnO-4被还原为棕色不溶物MnO2:
因MnO2能使溶液混浊,妨碍疑点观察,所以高锰酸钾法通常在较强的酸性溶液中进行。滴定时使用H2SO4控制酸度,避免使用HNO3(有氧化性)和HCL(有还原性)。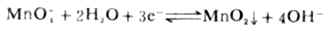
KMnO4还原为Mn2+的反应在常温下进行得较慢。因此,滴定较难氧化的物质时,常需要加热或加催化剂。例如,用KMnO4滴定C2O2-4时,即使在强酸性溶液中加热的情况下,开始时反应也不会迅速进行。只有待最初加入的1-2滴KMnO4溶液的紫色退去后,溶液中就有了Mn2+,接着的反应能较快地进行。这种由于反应生成物本身引起的催化作用称为自动催化作用。
高锰酸钾法的指示剂是KMnO4本身,在100ml水中只要加1滴0.1mol.L-1KMnO4溶液就可以呈现明显的紫红色.而它的还原产物Mn2+则近无色.所以高锰酸钾法不需另加指示剂。
KMnO4氧化性强,在强酸性溶液中可直接滴定一些还原性物质,如Fe2+,AsO3-3,NO-2,Sb3+,H2O2,C2O2-4,甲醛,葡萄糖和水杨酸等;也可间接滴定一些氧化性物质,如MnO2,PbO2,CrO-3,CLO-3等;还可测定一些能与氧化剂或还原剂起反应,但无氧化性或还原性的物质,如Ca2+,Ba2+,Zn2+和Cd2+等。例如,Ca2+能与C2O2-4形成沉淀溶于H2SO4中,然后用KmnO4溶液滴定生成H2C2O4,从而测出Ca2+的含量。
高锰酸钾法的主要缺点是选择性较差,标准溶液不够稳定等。
(二)高锰酸钾的应用示例——市售过氧化氢中H2O2含量的测定
在酸性溶液中,H2O2被KmnO4氧化。
2MnO-4+5H2O2+6H+→2Mn2+5O2+8H2o
氧化还原滴定同样也要经过标准溶液的配制、标定和被测物质含量测定三个过程:
1.KMnO4标准溶液的配制
称取约0.86g KMnO4加蒸馏水配成500ml0.01mol.L-1的标准溶液。加热至沸,并保持微沸约1h。冷却,放暗处约一周后用垂熔玻璃漏斗或玻璃丝过滤。将滤液移至棕色瓶内暗处保存。
2.KMnO4溶液浓度的标定
可用基准物质Na2CO3标定KMnO4溶液的浓度,反应式如下:
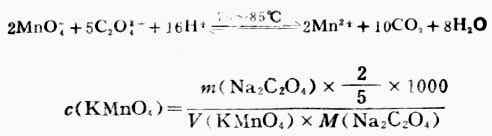
3.过氧化氢含量的测定
用移液管吸取市售过氧化氢1.00ml,放入250ml容量瓶中,稀释25.00ml于锥形瓶中,加6ml3mol.L-1H2SO4,用KMnO4标准溶液滴定溶液呈粉红色,设稀释后H2O2的密度为1,H2O2的含量可按下式计算:
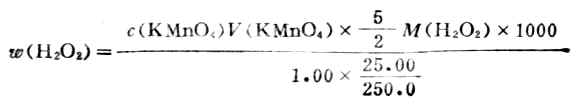
三、碘量法
(一)基本原理
碘量法是利用I2的氧化性和I-的还原性进行滴定的分析方法。
I2+2e-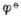 2I-
2I-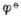 =0.535V
=0.535V
从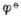 值可知,I2是一种较弱的氧化剂,而I-是中等 强度的还原剂 。低于
值可知,I2是一种较弱的氧化剂,而I-是中等 强度的还原剂 。低于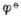 电对的还原性物质如S2-,SO2-3,AsO3-3,SbO3-3,维生素C等,能用I2标准溶液直接滴定,这种方法叫直接碘量法或碘滴定法。高于
电对的还原性物质如S2-,SO2-3,AsO3-3,SbO3-3,维生素C等,能用I2标准溶液直接滴定,这种方法叫直接碘量法或碘滴定法。高于 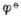 电对的氧化性物质如Cu2+,Cr2O2-7,CrO2-4,MnO2-4,NO-2,CL2,H2O2,漂白粉等,可将I-氧化成I2,再用Na2S2O3标准溶液滴定生成的I2。这种滴定方法叫间接碘量法或滴定碘量法。
电对的氧化性物质如Cu2+,Cr2O2-7,CrO2-4,MnO2-4,NO-2,CL2,H2O2,漂白粉等,可将I-氧化成I2,再用Na2S2O3标准溶液滴定生成的I2。这种滴定方法叫间接碘量法或滴定碘量法。
1.直接碘量法
用直接碘量法来测定还原性物质时,一般应在弱碱性、中性或弱酸性溶液中进行,如测定AsO3-3需在弱碱性NaHCO3溶液中进行。
若反应在强酸性溶液中进行,则平衡向左移动,且I-易被空气中的O2氧化:
4I-+O2+4H+→2I2+2H2O
如果溶液的碱性太强,I2就会发生歧化反应:
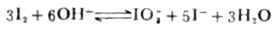
I2标准溶液可用升华法制得的纯碘直接配制。但I2具有挥发性和腐蚀性,不宜在天平上称量,故通常先配成近似浓度的溶液,然后进行标定。由于碘在水中的溶解度很小,通常在配制I2溶液时加入过量的KI以增加其溶解度,降低I2的挥发性。直接碘量法可利用碘自身的黄色或加淀粉作指示剂,I2遇淀粉呈蓝色。
2.间接碘量法
间接碘量法测定氧化性物质时,须在中性或弱酸性溶液中进行。例如,测定K2Cr2O7含量的反应如下:
Cr2O72-+6I-+14H+→2Cr3+3I2+7H2O
I2+2S2O22-→2I-+S4O2-6
若溶液为碱性,则存在如下事反应:
I2+S2O22-+10OH-→8I-+2SO42-+5H2o
在强酸性溶液中,S2O2-3易被分解:
S2O22-+2H-→S↓+SO2+H2O
间接碘量法也用淀粉作指示剂,但它不是在滴定前加入,若指示剂加得过早,则由于淀粉与I2形成的牢固结合会使I2不易与Na2S2O3立即作用,以致滴定终点不敏锐。故一般在近终点时加入。应用碘量法除须掌握好酸度外,还应注意以下几点:
(1)防止碘挥发。其办法有:
①加入过量的KI,使I2变成I-。
②反应时溶液不可加热。
③反应在碘量瓶中进行,滴定时不要过分摇动溶液。
(2)防止I-被空气氧化。方法有:
①避免阳光照射。
②Cu2+、NO-2等能催化空气对I-的氧化,应该设法除去。
③滴定应该快速进行。
(二)碘量法应用示例
1.维生素C含量测定
维生素C分子中含有烯二醇基,易被I2定量氧化成含二酮基的脱氢维生c,故可用直接碘量法测定定含量。
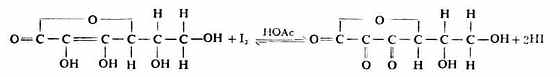
从上式可以看出,在碱性条件下有利于反应向右进行,但维生素C的还原性很强,在碱性环境中易被空气中的O2氧化,故滴定时加一些HOAc使滴定在弱酸性溶液中进行,以减少维被空气氧化所造成的误差。操作如下:
(1)配制0.05mol.L-1I2标准溶液 称取6.5gI2和12.5gKI,置于小研钵中,加水少许,研磨至全部溶解后移入棕色瓶中,加水500ml,摇匀后避光阴凉处放置过夜。
(2)标定I2溶液浓度 吸取25.00mlI2溶液置于250ml锥形瓶中,加水50ml,用标定过的Na 2S2O3标准溶液滴定至浅黄色后,加入0.2%淀粉溶液2-4滴,继续用Na2S2O3溶液滴定至蓝色恰好退去,根据下式计算I2溶液的浓度。
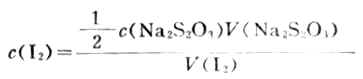
(3)维生素C含量的测定准确称取约0.2g维生素C,放入锥形瓶中,加入新蒸过的蒸馏水50ml2mol.L-1HOAc使其溶解,加淀粉指示剂1ml,立即用I2标准溶液滴定至浅蓝色,按下式计算维生素C的含量
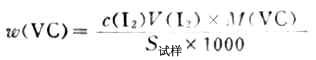
2.漂白粉中有效氯含量的测定
漂白粉的主要成分为CaCL(OCL)和CaCL2的混合物,前者与酸反应放出CL2具有漂白、杀菌和消毒作用,故称之为有效氯。漂白粉的质量是以有效氯的含量为衡量标准的。
CoCl(OCl)+2H+→Ca2++HOCl+HCl
HOCl+HCl→Cl2+H2O
操作步骤如下:
(1)配制0.1mol.L-1 Na2S2O3标准溶液 称取约2.5g Na2S2O3溶于500ml新煮并冷却的蒸馏水中,加少许Na2CO3,将溶液贮于棕色瓶中,在暗处放一周后标定其浓度.
(2)标定Na2S2O3标准溶液浓度 准确称取约0.15g在130-140℃烘干的分析纯K2Cr2O7,加水溶解后加过量KI和一定量的硫酸,加水稀释至约100ml。用待标定的Na2S2O3溶液滴定至呈黄绿色后,滴加淀粉指示剂,继续滴之下至溶液蓝色消失而呈亮绿色为止。根据下式计算溶液的浓度:
3.漂白粉中有效氯的测定 在漂白粉试样的酸性溶液中,加入过量的KI,然后用Na2S2O3标准溶液滴定生成I2,从而计算出有效氯含量。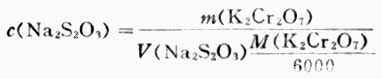
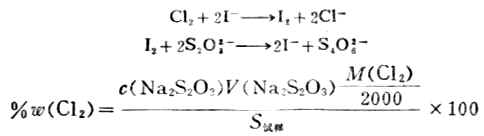
氧化还原滴定法是以氧化还原反应为基础的滴定分析方法。氧化还原反应较为复杂,一般反应速度较慢,副反应较多,所以并不是所有的氧化还原反应都能用于滴定反应,应该符合滴定分析的一般要求,即反应完全,反应速度快;无副反应等。因此,必须根据具体情况,创造适宜的反应条件。
(1)根据平衡常数的大小判断反应进行程度。一般K≥106或时,该反应进行得完全。
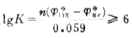
(2)反应速度快。一般可通过下列几种方法增加反应速度。
①加催化剂。例如,用MnO-4氧化Fe2+时,加入少许Mn2+作为催化剂,可使反应迅速进行。
②升高温度。例如,用MnO-4氧化C2O2-4时,室温下反应进行得很慢,温度升高到80℃时反应能够很快地进行。
(3)无副反应。若用于滴定分析的氧化还原反应伴有副反应发生,必须设法消除。如果没有抑制副反应的方法,反应就不能用于滴定。
按照氧化还原滴定中所用氧化剂的不同,将氧化还原法分为高锰酸钾法、碘量法、重铬酸钾法等。本节主要讨论高锰酸钾法和碘量法。
二、高锰酸钾法
(一)基本原理
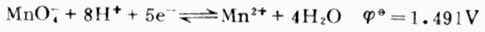
在微酸、中性或弱碱性溶液中,MnO-4被还原为棕色不溶物MnO2:
因MnO2能使溶液混浊,妨碍疑点观察,所以高锰酸钾法通常在较强的酸性溶液中进行。滴定时使用H2SO4控制酸度,避免使用HNO3(有氧化性)和HCL(有还原性)。
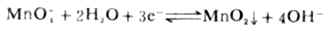
KMnO4还原为Mn2+的反应在常温下进行得较慢。因此,滴定较难氧化的物质时,常需要加热或加催化剂。例如,用KMnO4滴定C2O2-4时,即使在强酸性溶液中加热的情况下,开始时反应也不会迅速进行。只有待最初加入的1-2滴KMnO4溶液的紫色退去后,溶液中就有了Mn2+,接着的反应能较快地进行。这种由于反应生成物本身引起的催化作用称为自动催化作用。
高锰酸钾法的指示剂是KMnO4本身,在100ml水中只要加1滴0.1mol.L-1KMnO4溶液就可以呈现明显的紫红色.而它的还原产物Mn2+则近无色.所以高锰酸钾法不需另加指示剂。
KMnO4氧化性强,在强酸性溶液中可直接滴定一些还原性物质,如Fe2+,AsO3-3,NO-2,Sb3+,H2O2,C2O2-4,甲醛,葡萄糖和水杨酸等;也可间接滴定一些氧化性物质,如MnO2,PbO2,CrO-3,CLO-3等;还可测定一些能与氧化剂或还原剂起反应,但无氧化性或还原性的物质,如Ca2+,Ba2+,Zn2+和Cd2+等。例如,Ca2+能与C2O2-4形成沉淀溶于H2SO4中,然后用KmnO4溶液滴定生成H2C2O4,从而测出Ca2+的含量。
高锰酸钾法的主要缺点是选择性较差,标准溶液不够稳定等。
(二)高锰酸钾的应用示例——市售过氧化氢中H2O2含量的测定
在酸性溶液中,H2O2被KmnO4氧化。
2MnO-4+5H2O2+6H+→2Mn2+5O2+8H2o
氧化还原滴定同样也要经过标准溶液的配制、标定和被测物质含量测定三个过程:
1.KMnO4标准溶液的配制
称取约0.86g KMnO4加蒸馏水配成500ml0.01mol.L-1的标准溶液。加热至沸,并保持微沸约1h。冷却,放暗处约一周后用垂熔玻璃漏斗或玻璃丝过滤。将滤液移至棕色瓶内暗处保存。
2.KMnO4溶液浓度的标定
可用基准物质Na2CO3标定KMnO4溶液的浓度,反应式如下:
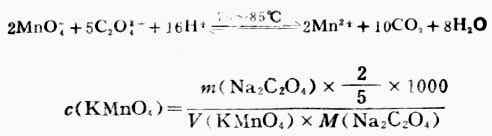
3.过氧化氢含量的测定
用移液管吸取市售过氧化氢1.00ml,放入250ml容量瓶中,稀释25.00ml于锥形瓶中,加6ml3mol.L-1H2SO4,用KMnO4标准溶液滴定溶液呈粉红色,设稀释后H2O2的密度为1,H2O2的含量可按下式计算:
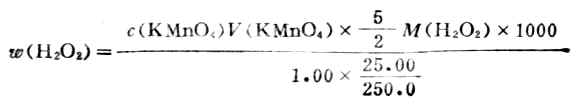
三、碘量法
(一)基本原理
碘量法是利用I2的氧化性和I-的还原性进行滴定的分析方法。
I2+2e-
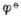 2I-
2I-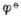 =0.535V
=0.535V从
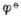 值可知,I2是一种较弱的氧化剂,而I-是中等 强度的还原剂 。低于
值可知,I2是一种较弱的氧化剂,而I-是中等 强度的还原剂 。低于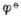 电对的还原性物质如S2-,SO2-3,AsO3-3,SbO3-3,维生素C等,能用I2标准溶液直接滴定,这种方法叫直接碘量法或碘滴定法。高于
电对的还原性物质如S2-,SO2-3,AsO3-3,SbO3-3,维生素C等,能用I2标准溶液直接滴定,这种方法叫直接碘量法或碘滴定法。高于 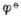 电对的氧化性物质如Cu2+,Cr2O2-7,CrO2-4,MnO2-4,NO-2,CL2,H2O2,漂白粉等,可将I-氧化成I2,再用Na2S2O3标准溶液滴定生成的I2。这种滴定方法叫间接碘量法或滴定碘量法。
电对的氧化性物质如Cu2+,Cr2O2-7,CrO2-4,MnO2-4,NO-2,CL2,H2O2,漂白粉等,可将I-氧化成I2,再用Na2S2O3标准溶液滴定生成的I2。这种滴定方法叫间接碘量法或滴定碘量法。1.直接碘量法
用直接碘量法来测定还原性物质时,一般应在弱碱性、中性或弱酸性溶液中进行,如测定AsO3-3需在弱碱性NaHCO3溶液中进行。
若反应在强酸性溶液中进行,则平衡向左移动,且I-易被空气中的O2氧化:

4I-+O2+4H+→2I2+2H2O
如果溶液的碱性太强,I2就会发生歧化反应:
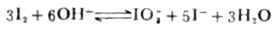
I2标准溶液可用升华法制得的纯碘直接配制。但I2具有挥发性和腐蚀性,不宜在天平上称量,故通常先配成近似浓度的溶液,然后进行标定。由于碘在水中的溶解度很小,通常在配制I2溶液时加入过量的KI以增加其溶解度,降低I2的挥发性。直接碘量法可利用碘自身的黄色或加淀粉作指示剂,I2遇淀粉呈蓝色。
2.间接碘量法
间接碘量法测定氧化性物质时,须在中性或弱酸性溶液中进行。例如,测定K2Cr2O7含量的反应如下:
Cr2O72-+6I-+14H+→2Cr3+3I2+7H2O
I2+2S2O22-→2I-+S4O2-6
若溶液为碱性,则存在如下事反应:
I2+S2O22-+10OH-→8I-+2SO42-+5H2o
在强酸性溶液中,S2O2-3易被分解:
S2O22-+2H-→S↓+SO2+H2O
间接碘量法也用淀粉作指示剂,但它不是在滴定前加入,若指示剂加得过早,则由于淀粉与I2形成的牢固结合会使I2不易与Na2S2O3立即作用,以致滴定终点不敏锐。故一般在近终点时加入。应用碘量法除须掌握好酸度外,还应注意以下几点:
(1)防止碘挥发。其办法有:
①加入过量的KI,使I2变成I-。
②反应时溶液不可加热。
③反应在碘量瓶中进行,滴定时不要过分摇动溶液。
(2)防止I-被空气氧化。方法有:
①避免阳光照射。
②Cu2+、NO-2等能催化空气对I-的氧化,应该设法除去。
③滴定应该快速进行。
(二)碘量法应用示例
1.维生素C含量测定
维生素C分子中含有烯二醇基,易被I2定量氧化成含二酮基的脱氢维生c,故可用直接碘量法测定定含量。
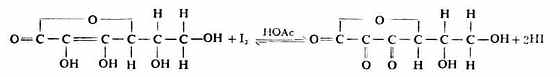
从上式可以看出,在碱性条件下有利于反应向右进行,但维生素C的还原性很强,在碱性环境中易被空气中的O2氧化,故滴定时加一些HOAc使滴定在弱酸性溶液中进行,以减少维被空气氧化所造成的误差。操作如下:
(1)配制0.05mol.L-1I2标准溶液 称取6.5gI2和12.5gKI,置于小研钵中,加水少许,研磨至全部溶解后移入棕色瓶中,加水500ml,摇匀后避光阴凉处放置过夜。
(2)标定I2溶液浓度 吸取25.00mlI2溶液置于250ml锥形瓶中,加水50ml,用标定过的Na 2S2O3标准溶液滴定至浅黄色后,加入0.2%淀粉溶液2-4滴,继续用Na2S2O3溶液滴定至蓝色恰好退去,根据下式计算I2溶液的浓度。
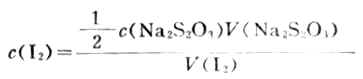
(3)维生素C含量的测定准确称取约0.2g维生素C,放入锥形瓶中,加入新蒸过的蒸馏水50ml2mol.L-1HOAc使其溶解,加淀粉指示剂1ml,立即用I2标准溶液滴定至浅蓝色,按下式计算维生素C的含量
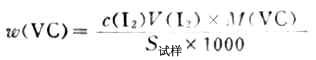
2.漂白粉中有效氯含量的测定
漂白粉的主要成分为CaCL(OCL)和CaCL2的混合物,前者与酸反应放出CL2具有漂白、杀菌和消毒作用,故称之为有效氯。漂白粉的质量是以有效氯的含量为衡量标准的。
CoCl(OCl)+2H+→Ca2++HOCl+HCl
HOCl+HCl→Cl2+H2O
操作步骤如下:
(1)配制0.1mol.L-1 Na2S2O3标准溶液 称取约2.5g Na2S2O3溶于500ml新煮并冷却的蒸馏水中,加少许Na2CO3,将溶液贮于棕色瓶中,在暗处放一周后标定其浓度.
(2)标定Na2S2O3标准溶液浓度 准确称取约0.15g在130-140℃烘干的分析纯K2Cr2O7,加水溶解后加过量KI和一定量的硫酸,加水稀释至约100ml。用待标定的Na2S2O3溶液滴定至呈黄绿色后,滴加淀粉指示剂,继续滴之下至溶液蓝色消失而呈亮绿色为止。根据下式计算溶液的浓度:
3.漂白粉中有效氯的测定 在漂白粉试样的酸性溶液中,加入过量的KI,然后用Na2S2O3标准溶液滴定生成I2,从而计算出有效氯含量。
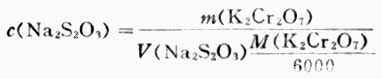
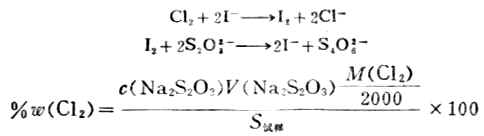
相关热词搜索:
论坛新帖
医学推广
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)