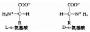氨基酸的一般代谢(来自37度医学网)
2012-06-13 23:07:34 来源:37度医学网 作者: 评论:0 点击:
蛋白质分解代谢首先在酶的催化下水解为氨基酸,而后各氨基酸进行分解代谢,或转变为其它物质、或参与新的蛋白质的合成。因此氨基酸代谢是蛋白质分解代谢的中心内容。
第一节 氨基酸的一般代谢
食物蛋白经过消化吸收后,以氨基酸的形式通过血液循环运到全身的各组织。这种来源的氨基酸称为外源性基酸。机 体各组织的蛋白质在组织酶的作用下,也不断地分解成为氨基酸;机体还能合成部分氨基酸(非必需氨基酸);这两种来源的氨基酸称为内源性氨基酸。外源性氨基 酸和内源性氨基酸彼此之间没有区别,共同构成了机体的氨基酸代谢库(metabolic pool)。氨基酸代谢库通常以游离氨基酸总量计算,机体没有专一的组织器官储存氨基酸,氨基酸代谢库实际上包括细胞内液、细胞间液和血液中的氨基酸。
氨基酸的主要功能是合成蛋白质,也合成多肽及其他含氮的生理活性物质。除了维生素之外(维生素PP是个例外)体内的各种含氮物质几种都可由氨基酸转变而成,包括蛋白质、肽类激素、氨基酸衍生物、黑色素、嘌呤碱、嘧啶碱、肌酸、胺类、辅酶或辅基等。
从氨基酸的结构上看,除了侧链R基团不同外,均有α-氨基和α羧基。氨基酸在体内的分解代谢实际上就是氨 基、羧基和R基团的代谢。氨基酸分解代谢的主要途径是脱氨基生成氨ammonia)和相应的α酮酸;氨基酸的另一条分解途径是脱羧基生成CO2和胺。 胺在体内可经胺氧化酶作用,进一步分解生成氨和相应的醛和酸。氨对人体来说是有毒的物质,氨在体内主要合成尿素排出体外,还可以合成其它含氮物质(包括非 必需氨基酸、谷氨酰胺等),少量的氨可直接经尿排出。R基团部分生成的酮酸可进一步氧化分解生成CO2和水,并提供能量,也可经一定的代谢反应转变生成 糖或脂在体内贮存。由于不同的氨基酸结构不同,因此它们的代谢也有各自的特点。
各组织器官在氨基酸代谢上的作用有所不同,其中以肝脏最为重要。肝脏蛋白质的更新速度比较快,氨基酸代谢活跃,大部分氨基酸在肝脏进行分解代谢,同时氨的解毒过程主要也在肝脏进行。分枝氨基酸的分解代谢则主要在肌肉组织中进行。
食物中蛋白质的含量也影响氨基酸的代谢速率。高蛋白饮食可诱导合成与氨基酸代谢有关的酶系,从而使代谢加快(图7-1)。

图7-1 氨基酸代谢的基本概况
一、氨基酸的脱氨基作用

图7-2 谷氨酸脱氢酶催化的氧化脱氢反应
脱氨基作用是指氨基酸在酶的催化下脱去氨基生成α酮酸的过程。这是氨基酸在体内分解的主要方式。参与人体蛋白质合成的氨基酸共有20种,它们的结构不同,脱氨基的方式也不同,主要有氧化脱氨、转氨、联合脱氨和非氧化脱氨等,以联合脱氨基最为重要。
(一)氧化脱氨基作用(Oxidative Deamination)
氧化脱氨基作用是指在酶的催化下氨基酸在氧化脱氢的同时脱去氨基的过程。
不需氧脱氢酶催化的氧化脱氨基作用
谷氨酸在线粒体中由谷氨酸脱氢酶(glutamate dehydrogonase)催化氧化脱氨。谷氨酸脱氢酶系不需氧脱氢酶,以NAD+或NADP+作为辅酶。氧化反应通过谷氨酸Cα脱氢转给 NAD(P)+形成α亚氨基戊二酸,再水解生成α酮戊二酸和氨(图7-2)。
谷氨酸脱氢酶为变构酶。GDP和ADP为变构激活剂,ATP和GTP为变构抑制剂。
在体内,谷氨酸脱氢酶催化可逆反应。一般情况下偏向于谷氨酸的合成(△G°′≈30kJ·mal1),因为高浓度氨对机体有害,此反应平衡点有助于保持较低的氨浓度。但当谷氨酸浓度高而NH3浓度低时,则有利于脱氨和α酮戊二酸的生成。
(二)转氨基作用
转氨基作用(Transamination)指在转氨酶催化下将α-氨基酸的氨基转给另一个α-是酮酸,生成相应的α酮酸和一种新的α-氨基酸的过程。
体内绝大多数氨基酸通过转氨基作用脱氨。参与蛋白质合成的20种α-氨基酸中,除甘氨酸、赖氨酸、苏氨酸和脯氨酸不参加转氨基作用,其余均可由特异的转氨酶催化参加转氨基作用。转氨基作用最重要的氨基受体是α酮戊二酸,产生谷氨酸作为新生成氨基酸:

进一步将谷氨酸中的氨基转给草酰乙酸,生成α酮戊二酸和天冬氨酸:

或转给丙酮酸。生成α酮戊二酸和丙氨酸,通过第二次转氨反应,再生出α酮戊二酸。

因而体内有较强的谷草转氨酸(glutamic pyruvic transaminase,GPT)和谷丙转氨酸(glutamic oxaloacetic trans aminase,GOT)活性。
转氨基作用是可逆的,该反应中△G°′≈0,所以平衡常数约为1。反应的方向取绝于四种反应物的相对浓度。因而,转氨基作用也是体内某些氨基酸(非必需氨基酸)合成的重要途径。
2.转氨基作用机理:
转氨基作用过程可分为两个阶段:
(1)一个氨基酸的氨基转到酶分子上,产生相应的酮酸和氨基化酶:
?

(2)NH2转给另一种酮酸,(如α酮戊二酸)生成氨基酸,并释放出酶分子:

为传送NH2基因,转氨酶需其含醛基的辅酶-磷酸吡哆醛(pyridoxal-5′ -phosphate,PLP)的参与。在转氨基过程中,辅酶PLP转变为磷酸吡哆胺(pyridoxamine5′phosphate,PMP)。 PLP通过其醛基与酶分子中赖氨酸ω氨基缩合形成Schiff碱而共价结合子酶分子中。
Esmond Snell,Alexande Branstein和David Metgler等揭示转氨作用是一种兵乓机制,二阶段各分三步进行(图7-3)。

图7-3 PLP依赖的酶促转氨基反应机理
第一阶段:氨基酸转变为酮酸
(1)氨基酸的亲核性NH2基团作用于酶PLp Schiff碱C原子,通过转亚氨基反应(transimination or transSchiffigation)形成一种氨基酸PLp Schiff碱,同时使酶分子中赖氨酸的NH2基团复原。
(2)通过酶活性位点赖氨酸催化去除氨基酸α氢,并通过一共振稳定的中间产物在PLP第4位C原子上加质子,将氨基酸桺Lp Schiff碱分子重排为一个α酮酸PMP schiff碱。
(3)水解生成PMP和α-酮酸。
第二阶段:α-酮酸转变为氨基酸
为完成转氨反应循环,辅酶必需由PMP形式转变为E-PLp-Schiff形式,此过程亦包括三步,为上述反应的逆过程。
(1)PMP与一个α-酮酸作用形成α-酮酸-Schiff碱。
(2)分子重排,α-酮酸-PMp-Schiff碱变为氨基酸-PLP-Schiff碱。
(3)酶活性位点赖氨酸ω-NH2基团攻击氨基酸-PLp-Schiff碱,通过转亚氨基生成有活性的酶-PLP Schiff碱,并释放出形成的新氨基酸。
转氨基反应中,辅酶在PLP和PMP间转换,在反应中起着氨基载体的作用,氨基在α-酮酸和α-氨基酸之间转移。可
见在转氨基反应中并无净NH3的生成。
3.转氨基作用的生理意义
转氨基作用起着十分重要的作用。通过转氨作用可以调节体内非必需氨基酸的种类和数量,以满足体内蛋白质合成时对非必需氨基酸的需求。
转氨基作用还是联合脱氨基作用的重要组成部分,从而加速了体内氨的转变和运输,勾通了机体的糖代谢、脂代谢和氨基酸代谢的互相联系。
(三)联合脱氨基作用
联合脱氨基作用是体内主要的脱氨方式。主要有两种反应途径:
1.由L-谷氨酸脱氢酶和转氨酶联合催化的联合脱氨基作用:先在转氨酶催化下,将某种氨基酸的α-氨基转移到α-酮戊二酸上生成谷氨酸,然后,在L-谷氨酸脱氢酶作用下将谷氨酸氧化脱氨生成α-酮戊二酸,而α-酮戊二酸再继续参加转氨基作用。
L-谷氨酸脱氢酶主要分布于肝、肾、脑等组织中,而α-酮戊二酸参加的转氨基作用普遍存在于各组织中,所以此种联合脱氨主要在肝、肾、脑等组织中进行。联合脱氨反应是可逆的,因此也可称为联合加氨。
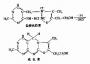
2.嘌呤核苷酸循环(purine nucleotide cycle):骨骼肌和心肌组织中L谷氨酸脱氢酶的活性很低,因而不能通过上述形式的联合脱氨反应脱氨。但骨骼肌和心肌中含丰富的腺苷酸脱氨酶 (adenylate deaminase),能催化腺苷酸加水、脱氨生成次黄嘌呤核苷酸(IMP)。

一种氨基酸经过两次转氨作用可将α-氨基转移至草酰乙酸生成门冬氨酸。门冬氨酸又可将此氨基转移到次黄嘌呤核苷酸上生成腺嘌呤核苷酸(通过中间化合物腺苷酸代琥珀酸)。其脱氨过程可用图7-4表示。

图7-4 腺嘌呤核苷酸循环
上一篇:个别氨基酸代谢(37度医学网)
下一篇:ATP的生成、储存和利用
论坛新帖
医学推广
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)