RNA转录后的加工与修饰
2012-01-25 19:22:03 来源:37度医学网 作者: 评论:0 点击:
(一)mRNA的加工修饰
原核生物中转录生成的mRNA为多顺反子,即几个结构基因,利用共同的启动子和共同终止信号经转录生成一条 mRNA,所以此mRNA分子编码几种不同的蛋白质。例如乳糖操纵子上的Z、Y及A基因,转录生成的mRNA可翻译生成三种酶,即半乳糖苷酶,透过酶和乙 酰基转移酶。原核生物中没有核模,所以转录与翻译是连续进行的,往往转录还未完成,翻译已经开始了,因此原核生物中转录生成的mRNA没有特殊的转录后加 工修饰过程。
真核生物转录生成的mRNA为单顺反子,即一个mRNA分子只为一种蛋白质分子编码。
真核生物mRNA的加工修饰,主要包括对5’端和3’端的修饰以及对中间部分进行剪接。
1.在5’端加帽
成熟的真核生物mRNA,其结构的5’端都有一个m7G-PPNmN结构,该结构被称为甲基鸟苷的帽子。如图 17-9所示。鸟苷通过5’-5’焦磷酸键与初级转录物的5’端相连。当鸟苷上第7位碳原子被甲基化形成m7G-PPNmN时,此时形成的帽子被称为“帽 0”,如果附m7G-PPNmN外,这个核糖的第“2”号碳上也甲基化,形成m7G-PPNm,称为“帽1”,如果5’末端N1和N2中的两个核糖均甲基 化,成为m7G-PPNmPNm2,称为“帽2”。从真核生物帽子结构形成的复杂可以看出,生物进化程度越高,其帽子结构越复杂。

图17-9 Post-transcriptional modification of mRNa showing the 7-methylguanosine cap and poly-A tail.
真核生物mRNA 5’端帽子结构的重要性在于它是mRNa 做为翻译起始的必要的结构,对核糖体对mRNA的识别提供了信号,这种帽子结构还可能增加mRNA的稳定性,保护mRNa 免遭5’外切核酸酶的攻击。
2.在3’端加尾
大多数的真核mRNA 都有3’端的多聚尾巴(A),多聚(A)尾巴大约为200bp。
多聚(A)屠巴不是由DNA编码的,而是转录后在核内加上去的。受polyA聚合酶催化,该酶能识别,mRNa 的游离3’-OH端,并加上约200个A残基。

近年来已知,在大多数真核基因的3’一端有一个AATAA序列,这个序列是mRNa 3’-端加polyA尾的信号。靠核酸酶在此信号下游10-15碱基外切断磷酸二酯键,在polyA聚合酶催化下,在3’-OH上逐一引入100-200 个A碱基。关于polyA尾巴的功能问题尽管经过极其广泛的探索,但还不完全清楚。有人推测polyA可能与mRNA从细胞核转送到细胞质有关,但是相当 数量,的没有polyA屠巴的mRNA如组蛋白mRNA,也照样通过核膜进入细胞质。还有人认为这种结构对真核mRNA的翻译效率具有某种作用,并能稳定 mRNA结构,保持一定的生物半衰期。
3.mRNA前体(hnRNA)的拼接
原核生物的结构基因是连续编码序列,而真核生物基因往往是断裂基因,即编码一个蛋白质分子的核苷酸序列被多个 插入片断所隔开,一个真核生物结构基因中内含子的数量,往往与这个基因的大小有关,例如胰岛素是一个很小的蛋白质,它结构基因只有两个内含子,而有些很大 的蛋白质,它的结构基因中可以有几十个内含子。经过复杂的过程后,切去内元,将有编码意义的核苷酸片段(Extron外元也叫外显子)连接起来(图 17-10)。

图17-10 Primary polymerase 11transcript of a eukaryote gene showing (a)introns after capping and addition of polyA tail.(b)Excision of introns to form the mature mRNA is called splicing.
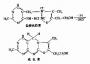
真核生物的结构的基因中具有可表达活性的外显子,也含有无表达活性的内含子,但内含子序列下是无意义的,越来 越多的实验证明有许多基因中的内含子参与基因表达调控,在转录时,外显子及内含子均转录到hnRNA中。在细胞核中hnRNA进行剪接作用,首先在核酸内 切酶作用下剪切掉内含子;然后在连接酶作用下,将外显子各部分连接起来,而变为成熟的mRNA,这就是剪接作用,也有少数基因的hnRNA不需进行剪接作 用,例如α-干扰素基因,图17-11以卵清蛋白基因为例,介绍一个典型的转录及加工过程。

图17-11 卵清蛋白基因转录及加工过程
图中外显示以1、2、3、4……表示,内含子以A、B、C、D…表示
mRNA的拼接,需要在拼接部位有供拼接识别的保守性强的一致顺序,通过对100多种真核细胞基因的分析,发现外元和内元拼接部位部分碱基顺序有一定的规律(见表17-4)。
表17-4 含有内元的转录产物其拼接处的碱基顺序
基因区域 Exon Intron Exon 卵清蛋白内元2 UAAG GUGA ~~~~~~~ ACAGGUUG 卵清蛋白内元3 UCAG GUAC ~~~~~~~ UCAGUCUG β-珠蛋白内元1 GCAG GUUG ~~~~~~~ UCAGGCUG β-珠蛋白内元2 CAGG GUGA ~~~~~~~ ACAGUCUC Igλ内含子1 UCAG GUCA ~~~~~~~ GCAGGGGC SV40病毒早期T抗原 UAAG GUAA ~~~~~~~ UUAGAUUC表中划线的碱基对拼接识别有重要作用,如将兔的β-珠蛋白的拼接部位的GT改为AT后,拼接反应即受到影响。
mRNA前体拼机制

图17-12 The RNA splicing mechanism.RNA splicing is catalyzed by a spliceosome formed from the assembly of U1,U2,U5,and sn RNPs(shown as green circles )plus other components (not shown).After assembly of the spliceosome ,the reaction occures in two speps:in step 1the branch-point A nucleotide in the intron sequence,which is located colse to the 3'splice site ,attacks the 5'splice site and cleaves it;the cut 5'end of the intron sequence thereby becomes covalently linked to this A nucleotide,forming the branched nucleotide shown in Figure 8-55.In step 2 the 3'-OH end of the first exon sequence,which was created in the first step,adds to the beginning of the second exon sequence,cleqving the RNA molecule at the 3'splice site;the two exon sequences are thereby joined to each other and the intron sequence is released ad a ribosone.These splicing reactions occur im the nucleus and gengerate mRNa molecules from primary RNA transcripts (mRNA precursor molecules).
mRNA拼接反应需要有核内小分子RNA参与它们与蛋白质形成的复合物称为小核糖核蛋白颗粒,SnR
NA分别被命名为U1,U2,U3,U4,U5,和U6RNA。SnRNA中的U2RNA由与内元右端拼接部位附近的UACUAA顺序高度互补,形成一个环状结构,由特定的酶来识别切除该环状结构,完成拼接过程,如图17-12所示。

图17-13 Mechanim of mRNa splicing.Note that,for clarity,the process is shown in two stages;energy is not required for the process since transesterification reactions are involved.
真核生物 mRNA前体在剪接过程中,还可以形成套索样的结构,在内含子序列中常有一个分支部位的腺苷酸残基,它的2’-OH可以自动攻击内含子5’端与外显子1连 接的磷酸二酯键,切开了外噗子1,而腺苷酸原来已有3’,5’--磷酸二酯键相连的两个相邻的核苷酸残基,加上此3’,5’-磷酸二酯键连接后,在腺苷酸 处出现了一个套索,已被切下的外显子1的3’-OH攻击内含子3’末端与外显子2之间的3’,5’-磷酸二酯键,键断裂后,内含子以套索的形式被节下来, 此时外显子1和外显子2可以连接起来(图17-13)。
不论拼接过程如何,拼接必须极为精确,否则会导致遗传信息传递障碍,合成的蛋白质可能丧失其正常的功能。我国南方广大地区是β-地中海贫血的 高发区,这是由于β-珠蛋白链的合成受到部分或完全抑制所引起的一种血红蛋白病。实验表明β-珠蛋白基因元1中核苷酸的点突变改变了正常拼接部位的碱基顺 序,结果造成错误部位的拼接。加工成熟的mRNA虽能翻译,但产物不是正常的β-珠蛋白,结果引起血红蛋白级结构和功能的改变。
(二)rRNA转录后加工
原核生物rRNA转录后加工,包括以下几方面:①rRNA前体被大肠杆菌RNaseⅢ,RNaseE等剪切成一定链长的rRNA分子;②rRNA在修饰酶催化下进行碱基修饰;③rRNA与蛋白质结合形成核糖体的大、小亚基(见图17-14)

图17-14 大肠杆菌rRNA前体的加工
真核生物rRNA前体比原核生物大,哺乳动物的初级转录产物为45s,低等真核生物的rRNA前体为38s,真核生物5sRNA前体独立于其他三种rRNA的基因转录(图17-15)。

图17-15 真核生物rRNA前体的加工
真核生物rRNA前体中含有插入顺序,rRNA前体要形成成熟的rRNA,需要经过拼接反应。例如,四膜虫的rRNA前体的拼接是一种无酶催化的自动拼接过程。四膜虫基因组内,26srRNA 编码的区域内有413bp的插入顺序。该插放序列可以不消耗能量从rRNA前体中被除掉。用SDS煮沸和用蛋白酶外理等破坏酶活性办法,都不能破坏拼接活 性,但反应中Mg2+和鸟嘌呤核苷酸是必在的。用32P-GTP进行追踪实验表明,起始过程是GTP在插入顺序5’端发生亲核反应,同时GMP与5’端切 点的切除段形成磷酸二酯键并使原RNA断开。第二步是5’切点的外元3’-OH与3’切点的外元5’-P共价连接,获得成熟的rRNA,被切除部分最后环 化,形成一个环状结构,同时从5’端去掉一个15核苷酸啐片。剩余部分连接成399核苷酸的环状产物,再经过几步,最后切下一个19个核苷酸的线性内含子 序列即L-19,它具有催化活性,上面的剪接作用,是由内含子本身的催化性质决定的(图17-16)。

图17-16 四膜虫rRNA前体的自我剪接
这种rRNA的自身剪接反应给人们一个提示:即RNA分子也有酶的催化活性。这向酶的化学本质是蛋白质这一传 统概念提出了挑战。这种有酶催化活性的RNA分子命名为Ribozyme。T.Cech和S.Altman各自分别发现RNA具有催化作用,他们的发现对 于了解生命进行过程有重要意义。很可能在原始生命中,RNA所催化的断裂一连接反应是最早出现的催化过程。为此,他们共同获得了1989年Nobel化学 奖。
从大多数Ribozymw的结构中发现一些特征,例如:锤头状结构的RNA分子有13个保守的核苷酸序列,如果它们中的碱基改变会使这种催化活性失去作用。根据这种特片,科学家们在体外没计并人工合成这种RNA分子,用于抗肿瘤及抗病毒的实验中(图17-17)。

图17-17 锤头结构模式图
(三)tRNA转录后的加工修饰
原核生物和真核生物刚转录生成的tRNA前体一般无生物活性,需要进行①剪切和拼接②碱基修饰③3’-OH连接-ACC结构(图17-18)。

图17-18 tRNA前体的加工
①tRNA前体在tRNA剪切酶的作用下,切成一定在小的tRNA分子。大肠杆菌RNase P可特异剪切tRNA前体的5’旁顺序,因此,该酶被称为tRNA5’成熟酶。除了RNaseP外,tRNA前体的剪切尚需要一个3’-核酸内切酶,这可 将tRNA前体3’端的一段核苷酸序列切下来。此外RNaseD是tRNA3’端成熟酶。近年来的研究表明大肠杆菌RNaseP是一种非常特殊的酶分子, 它是由RNA和蛋白质组成, 最近发现RNAaseP分子中的RNA部分在某些条件下,可以单独地催化tRNA前体的加工成熟,这个发现和四膜虫tRNA能自我拼接被认为是近十年来生 化领域内最令人鼓舞的发现之一。说明RNA分子确具有酶的催化活性。经过剪切后的tRNA分子还要在拼接酶作用下,将成熟tRNA分子所需的片段拼起来。
②成熟的tRNA分子中有许多的稀有碱基,因此tRNA在甲基转移酶催化下,某些嘌呤生成甲基嘌呤如A→mA,G→mA。有些尿嘧啶还原为双氢尿嘧啶。尿嘧啶核苷转变不假尿嘧啶核苷。某些腺苷酸脱氨基为成为次黄嘌呤核苷酸(Ⅰ)
③3’末端加上CCA:在核苷酸转移酶作用下,3’--末端除去个别碱基后,换上tRNA分子统一的CCA-OH末端,完成tRNA分子中的氨基酸臂结构。
论坛新帖
医学推广
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)