第二章 细胞的基本功能
2011-06-08 18:12:43 来源: 作者: 评论:0 点击:
第二节 细胞的信号转导
(Signal transduction of the cell)
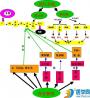
生物体从受精卵开始直至整个生命过程,自始至终都要受遗传信息及环境变化信息的调节控制。遗传信息决定生物体新陈代谢、生长发育及各种生物功能活动的基本模式。而环境变化信息则调控上述所有这些过程,这些信息主要是指生物体外界及身体内部环境变化的信息,即各种刺激信号。这些刺激信号作用于细胞的特殊结构(通常是受体),通过一系列反应,实现对细胞功能活动调控的信息传递过程被称为信号转导。显而易见,细胞的信号转导是多细胞生物,尤其是高等动物细胞间信息交换、各种功能协调及生物个体的生存发育、繁衍的最基本最重要的细胞功能之一。它是一个非常复杂的过程,涉及多个环节,包括细胞外各种信号(如神经递质及激素)、细胞的接受系统(受体),胞内参与信息传递的信号分子(如cAMP)及细胞内反应系统(各种效应蛋白及靶基因)。
一、 信号转导概述
(The overview of Signal transduction)
(一)细胞外刺激信号
可作用于机体的刺激信号种类繁多,性质各异。体外信号包括物理性(光、声、电、温度)、化学性(空气、环境中的各种化学物质)、生物性(细菌、病毒、寄生虫)信号。体内信号通常指化学信号,即各种生物活性物质(如激素、递质等)所携带的信号。激素或递质在体内的主要功能就是传递信息,即告知靶细胞在其周围环境中存在着某种刺激因素,从而诱导细胞的适当反应。依据其产生方式可将细胞外各种刺激信号分为三种基本类型:即来源于神经细胞的递质、内分泌系统的激素、免疫系统产生的各种细胞因子以及以类似的方式产生的生长因子。还有一些特殊物质,如气体分子NO等。
(二)受体及其特征
1.受体的概念及分类
受体是位于质膜或细胞内能与胞外信号物质结合并能引起特定生物效应的大分子物质。受体也是刺激信号作用于细胞发挥调节作用的第一个环节,换句话说受体是细胞接受刺激的"门户"。依照受体的结构及跨膜信号转导方式通常将受体分为四种基本类型:G蛋白耦联受体、具有酶活性的受体、离子通道型受体及核受体。
2.受体与配体结合的主要特征
配体是指能与受体结合的特异性物质,通常是体内的各种化学信号如激素或递质。受体与配体的结合是受体被激活,引起信号传递并产生生物学效应的初始因素。其特征是:①特异性,受体与配体的识别和结合是一个复杂过程,但重要的特征是具有特异性类似于酶和底物的结合过程。由于受体能识别并结合特殊的信号物质,因而保证了信号传递的特异性;②高亲和力,虽然配体分子(如激素)在体液中浓度很低,通常在10-9mol/L或更低,但仍能与受体特异性结合并发挥巨大的生物学效应,说明配体与受体的亲和力很高,这保证了信号传递的可靠性;③饱和性,由于受体数量有限,因此配体与受体的结合有个上限,当用浓度递增的配体与之相互作用时,会发现当配体达到某一浓度时,结合作用达到平衡,即表现出受体结合的饱和性。
(三)信号转导的基本过程
不同类型的受体介导的信号转导过程虽有很大差别,但也有共同之处。下面以G蛋白为例简单说明膜受体介导的信号转导的基本过程。从信号物质(配体)与受体结合开始,跨膜信号转导过程包括膜的信号转换、胞内信号传递以及最终引发生物学效应的不同环节。由于大多数信号物质不能进入胞内,而最终产生的生物学效应是在胞内,因此胞外信号必须经过一个跨膜转换的中间环节,否则将由于膜的阻隔而使信号中断。膜的信号转换除受体外还涉及膜上的G蛋白及G蛋白的效应器,其结果是形成了第二信使;胞内信号传递过程涉及第二信使、蛋白激酶等;整个信号转导过程是一个以酶促反应为主的级联反应。在此过程,胞外信号逐次由膜传至胞内,同时其生物学作用也得到了逐级放大,并最终产生各种生物学效应。通过信号转导引起的细胞内反应,通常包括三个方面,即膜电位改变或细胞兴奋性改变及由此引起的细胞功能改变;各种效应蛋白由于构型改变引起的功能变化,如酶蛋白活性改变及由此引起的代谢反应改变;基因表达过程的改变,如某一个基因转录的启动或关闭。
二、 跨膜信号转导途径
(Transmembrane signal transduction pathways)
(一)G蛋白耦联受体介导的信号转导
G蛋白耦联受体是迄今为止发现的最大的受体家族。当受体与配体结合使受体活化后,都要与一组能与GTP结合的称之为G蛋白的调节蛋白相互作用,完成胞内信号传递作用。与其它信号转导途径相比,该途径涉及的信号分子以及级联反应最多。除涉及膜上的一些蛋白质,如受体、G蛋白、及G蛋白效应器外,还涉及细胞内的第二信使、蛋白激酶及效应蛋白,即引起细胞反应的功能蛋白,如酶或转录因子。以下首先介绍该信号系统的信号分子,然后再描述具体的信号转导过程。
1.G蛋白耦联受体信号通路中的信号分子
(1)G蛋白耦联受体 G蛋白耦联受体是最大的受体家族。此类受体共同的结构特征是由一多肽链组成,并形成7个跨膜区段(TM)。各区段之间由数量不同的氨基酸残基组成的3个胞外环和3个胞内环相连。受体多肽链的N末端位于胞内。该家族中的不同受体,其组成跨膜区段的氨基酸残基同源性较高,而N末端、C末端及胞内、胞外环的氨基酸残基在组成和数量上都有很大差异,这正是不同信号转导途径中,受体与配基选择性识别、结合及对G蛋白选择性作用的结构基础。当配体与受体结合后,引起受体构型改变,激活G蛋白,通过G蛋白再将信号依次传至下游的信号分子。
(2)G蛋白 G蛋白是指GTP结合蛋白。最早由Rodbell、Gilmam 等分离纯化并命名。已经证实的G蛋白已达20多种,其共同特征是:①静息时由a、b、γ三个亚单位组成三聚体;②存在有两种形式,即结合GDP的非活性形式和结合GTP的活性形式;③可被受体与配体的结合而激活,活化后结合的GDP变成GTP,同时静息时的三聚体蛋白分为两部分,即b、γ亚单位复合体和a亚单位GTP复合体;④由于a亚单位具有鸟苷酸(GTP或GDP)结合位点、以及与受体及效应蛋白的作用位点,同时还具有GTP酶的活性,因而在G蛋白激活及信号转导中发挥至关重要的作用。如通过a亚单位与受体相互作用、与GDP和GTP交替结合调控G蛋白活性及激活其效应蛋白,使信号转至胞内。
在人体各组织中,G蛋白具有不同的类型。通常是以a亚单位的结构与活性,将其分为三类:Gs、Gi及Gq。Gs即兴奋型G蛋白,它们活化后可对效应蛋白(如腺苷酸环化酶)发挥激活作用;Gi即抑制型G蛋白,它们可抑制效应蛋白的活性,如抑制腺苷酸环化酶的活性,从而减少cAMP的生成;而Gq型则主要作用于磷酯酶C,参与对IP3、DG的调节。G蛋白的激活起始于配体与受体的结合。在静息状态G蛋白与受体是分离的,此时a亚单位结合GDP,并与b、γ亚单位形成三聚体。当配体与受体结合后,受体发生构型改变,与G蛋白的a亚基结合并激活G蛋白,被活化后的G蛋白,其a亚单位与鸟苷酸的亲和力发生改变,表现为对GDP的亲合力下降,而对GTP的亲合力增加。导致a亚单位与GDP解离并与GTP结合。与GTP的结合诱发了G蛋白的构象改变,导致a亚单位与受体分离,同时也与b、γ亚单位分离,使静息时的三聚体G蛋白解离而形成两个部分:即b、γ亚单位复合体,a亚单位GTP复合体,后者是发挥调节作用的功能形式。G蛋白激活是短暂的,当a亚单位GTP复合物作用于效应蛋白触发信号传递的同时,a亚单位的GTP酶活性表现出来,将结合的GTP水解为GDP。a亚单位与GDP的结合导致其与效应蛋白分离,并重新与b、γ亚单位结合从而恢复到静息状态非活性形式的三聚体G蛋白。在上述的激活过程中,a亚单位与GTP的结合及GTP的水解是控制G蛋白活性的关键。另有资料表明,b、γ亚单位复合体也可调节某些效应蛋白的活性。
(3)G蛋白效应器 G蛋白活化后进一步作用于膜上的另一类蛋白质,即G蛋白效应器。它们多数是能催化生成第二信使的酶,如生成cAMP的腺苷酸环化酶以及生成cGMP的鸟苷酸环化酶等。因此,当G蛋白被激活并作用于这些下游分子时,通过生成胞内的第二信使并由此将信号传至胞内。
(4)第二信使 cAMP是第一个被证实的第二信使(second messenger),它是基于肾上腺素对肝糖原分解代谢的实验观察而发现的。体外实验证实,肾上腺素可加速肝细胞糖原分解的过程。在此过程,肾上腺素可明显提高糖原磷酸化酶的活性,这是糖原分解过程主要的限速酶。但同时发现,肾上腺素直接加入糖原磷酸化酶的纯制剂,却不能将其激活,必须再加入肝细胞匀浆(包含有细胞膜、细胞器的碎片)才能使酶激活。说明肾上腺素不能直接激活糖原磷酸化酶。随后的实验证实,肾上腺素通过作用于细胞膜,在胞内产生一种被称作cAMP的小分子物质,由此导致酶的激活及糖原分解。之后陆续发现许多激素在细胞内都通过cAMP发挥作用。基于上述事实,发现者Surtherland提出了第二信使学说,即胞外信号首先作用于膜受体,通过膜的信号转换过程,产生了胞内的信号分子及胞内的信号传递过程,由此诱发细胞的各种反应。以膜为界,将胞外的信号物质如激素或递质称作第一信使,而胞内的信号分子如cAMP称作第二信使。第二信使学说的创立奠定了跨膜信号转导机制的理论基石。在发现胞内第二信使之前,由于膜的阻隔,我们对细胞内发生的各种功能活动了解甚少。而随着这一学说的创立,以及之后一系列跨膜转导机制的研究成果,使我们的视线伴随着胞外信号一同跨越质膜,而深入到细胞内部,使我们开始了解刺激信号在细胞内引起的各种调节活动及最终产生的生物学效应。显然,这是理解正常的生理功能、生化代谢、基因表达过程及各种病理机制的非常重要的基础。为此,诺贝尔奖评选委员会将1971年度生理学及医学奖授予了发现cAMP并创立第二信使学说的伟大科学家Surtherland,以表彰他所做的开创性工作。除cAMP外,第二信使物质还包括cGMP、IP3、DG、Ca2+等。
(5)蛋白激酶 蛋白激酶是指能催化蛋白质磷酸化的酶系统。依照磷酸化的底物蛋白的不同,可将其分为两种类型,即丝氨酸/苏氨酸蛋白激酶和酪氨酸蛋白激酶。前者是使蛋白质中的丝氨酸或苏氨酸残基磷酸化,这占了蛋白激酶中的绝大多数;后者是使蛋白质中的酪氨酸残基磷酸化,是为数不多的蛋白激酶,主要涉及酶耦联受体的信号转导通路。磷酸化是一个可逆的过程,涉及蛋白激酶、蛋白磷酸酶和底物蛋白。蛋白激酶的作用是催化底物蛋白的磷酸化,即将磷酸根转移到底物蛋白的特定氨基酸残基上。由于磷酸根携带大量负电荷,当它与蛋白质结合后,通过影响多肽链的折叠改变蛋白质的空间构型,因而改变其生物学效应。与磷酸化相反的过程是脱磷酸化,依靠磷酸酶催化这一过程。从而使磷酸化成为一个可逆性的过程,保证了在信号分子的作用减弱或消除时,由磷酸化引起的生物效应及时终止。不管信号转导通过何种途径进行,完成其终端反应的效应器都是细胞内各种功能蛋白,如受体、收缩蛋白、离子通道及酶或各种转录调节因子,而这些蛋白质的功能状态往往取决于它们的磷酸化程度。即这些功能蛋白由于发生了磷酸化或去磷酸化反应,而导致其功能改变,表现出相应的生物学效应。如酶活性改变引起的代谢反应的改变;通道功能改变引起的离子跨膜移动及由此形成的膜电位的改变;收缩蛋白功能改变引起的收缩或舒张以及转录因子活性改变引起的基因表达的改变等等。因此,蛋白质的磷酸化反应构成了细胞内最基本和最重要的调节反应,涉及几乎所有生理及病理过程。
2.G蛋白耦连受体信号转导途径
(1)受体-G蛋白-cAMP-PKA 途径
配体与受体的结合激活了G蛋白,被活化的G蛋白作用于膜上的另一种蛋白质,即G蛋白效应器,腺苷酸环化酶(adenylate cyclase,AC)是重要的一种,它的作用是催化生成第二信使cAMP。能作用于AC的G蛋白有两种类型,即Gs和Gi。正如前述,Gs是兴奋型G蛋白,活化后可激活AC;而Gi是抑制型G蛋白,它的作用是抑制AC的活性。生成的cAMP通过磷酸二酯酶迅速降解,从而保证了cAMP作为第二信使发挥作用的敏感性。cAMP广泛存在于真核细胞,并发挥重要的信号作用。它们绝大多数通过活化依赖cAMP的蛋白激酶(PKA),促进蛋白质的磷酸化,从而诱发多种细胞反应。这种作用取决于磷酸化的靶蛋白或效应蛋白。若靶蛋白为细胞内的功能蛋白如酶则引起生化代谢的改变。若磷酸化的是转录因子则会影响基因表达过程。如PKA可使一种称作cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)的转录因子磷酸化从而被激活,活化的CREB则可与DNA分子上的特定区域,也称cAMP反应元件(cAMP response element,CRE)结合,从而启动基因的表达。
(2)受体-G蛋白-DG/PKC途径
一些胞外信号与膜受体结合后,还可激活另一种G蛋白(Gq),后者激活膜上的一种特异的脂质水解酶-磷脂酶C(phospholipase,PLC)。PLC水解膜脂质中的二磷酸磷脂酰肌醇(phosphatidylinositol-biphosphate,PIP2),同时生成三磷酸肌醇(IP3)和二酰甘油(DG)。生成的DG可以通过激活胞内的另一种蛋白激酶即蛋白激酶C(PKC)而发挥作用。PKC有多种亚型,通过使底物蛋白磷酸化,发挥多种生物效应,包括对许多生理功能及生化代谢的调节。如PKC可使Ca2+泵激活,加速Ca2+的转运从而参与胞内Ca2+稳态的维持;可使胰岛素受体磷酸化从而调节其活性;另外,PKC还参与基因转录过程的调节,如参与MAPK(见后)的活化过程等。
(3)受体-G蛋白-IP3/Ca2+系统
如上所述,在PLC被激活生成DG的同时也生成了IP3。IP3与DG虽然同时生成,但它们的作用途径和方式却不相同。DG通过激活PKC发挥作用,而IP3则主要通过作用于内质网或肌浆网膜的IP3受体,调节胞内Ca2+浓度而参与Ca2+信号的调节。实验证实,IP3受体是一种化学门控性Ca2+通道,被IP3及其它物质激活而开放,导致胞内Ca2+库的Ca2+释放至胞浆,使胞内Ca2+浓度升高。而Ca2+作为第二信使,在信号转导过程和细胞功能调节中发挥广泛和重要的作用。Ca2+主要通过与钙结合蛋白如钙调蛋白(calmodulin,CaM)结合形成CaM-Ca2+复合物,该复合物再激活依赖CaM的蛋白激酶,催化底物蛋白的磷酸化反应,从而发挥调节作用。
(4)受体-G蛋白-离子通道途径
绝大多数情况下,G蛋白是通过第二信使、蛋白激酶促使蛋白质磷酸化来发挥作用的,但也可直接或通过第二信使调节离子通道,从而影响细胞的功能活动。如心肌细胞膜上的M2受体与ACh结合后激活了Gi,后者直接作用于K+通道使其开放,发挥对心肌的抑制作用。但G蛋白对离子通道的影响更多的是通过第二信使来发挥作用。如视杆细胞外段存在有cGMP门控的Na+通道。无光照时,cGMP维持其通道开放,而有光照刺激时,经过一系列光化学反应激活了一种被称作Gt的G蛋白,并由此激活了磷酸二酯酶,后者引起了cGMP的水解,使cGMP依赖的Na+通道关闭,从而产生了相应的电位变化即视杆细胞的感受器电位。
(二)具有酶活性的受体介导的信号转导
具有酶活性的受体包括两大类:一是受体分子本身具有酶(酪氨酸激酶)的活性,即受体与酶是同一蛋白分子,被称作酪氨酸激酶受体(tyrosine kinase receptor);另一类是受体分子本身不具有酶的活性,活化后的下游靶蛋白具有激酶功能,因而称为酪氨酸激酶耦联受体。对酪氨酸激酶受体来说,其特异性配体主要是各种类型的生长因子,如神经营养因子、表皮生长因子、胰岛素样生长因子。这类受体通常由一条肽链组成,只有一个跨膜a-螺旋。按功能将整个分子分为三个结构区,即胞外的配体结合区、跨膜区及胞内具有酪氨酸激酶活性的区域。当配体与受体结合后,导致受体形成二聚体而被活化,然后通过Ras-MAPK信号系统发挥作用。Ras是一种被称之为小G蛋白的信号分子,因其结构是单亚基蛋白,分子量也小故取名为小G蛋白。但它同样能与GTP结合而处于活化形式,只是这种信号分子主要参与酪氨酸激酶受体的信号传递过程。丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK),被活化后进入核内作为转录因子影响基因的表达。
酪氨酸激酶耦联受体的配体,大多是细胞因子,如白介素、干扰素等。该类受体的特征是受体本身不具有酶的活性,但可激活具有酪氨酸激酶活性的一些靶蛋白,它们通常也作为转录因子参与基因表达的调控。
同G蛋白受体介导的信号转导途径相比,酪氨酸激酶受体介导的信号转导途径呈现如下特征:①简单快捷,当配体与受体蛋白的胞外段结合后,通过构型改变直接激活了位于受体胞内段的酪氨酸激酶,再通过对下游靶蛋白的磷酸化反应完成其调节活动。因而省去了受体与配体结合之后,G蛋白及效应器激活的中间过程,因此无需G蛋白中介,也不产生第二信使;②此类受体的配体是各种生长因子和细胞因子;③该信号系统在细胞内激活的效应蛋白大多是转录因子,因而最终产生的生物学效应通常都是基因转录的调节。
(三)通道耦联的受体介导的信号转导
受体最主要的功能,是通过识别并结合特异性的配体而接受信息。但随着研究的深入,发现受体的功能越来越复杂。如前述的酪氨酸激酶受体,除具有受体功能外,还兼具酪氨酸激酶的功能。而这里描述的通道耦联的受体,同样是具有复合功能的跨膜蛋白。它们既可识别、结合特异的配体发挥受体的功能,同时又是通道,因此也称作配体门控的通道或通道耦联的受体。这类受体包括烟碱型乙酰胆碱受体(nAChR)、谷氨酸的离子型受体、γ-氨基丁酸的离子型受体等,它们的配体通常是神经递质。配体与受体结合后直接影响通道的状态,使其开放并允许离子跨膜移动,从而改变细胞膜电位,改变其兴奋性。整个信号转导过程只涉及膜通道功能的改变,及随之引起的膜电位的变化,没有胞内其它信号分子的参与,这是胞外信号对靶细胞作用的一种简单直接的方式。因此,通常把胞外信号引起的靶细胞的这种反应称为快反应途径,而通过G蛋白、第二信使引起的靶细胞的功能变化称作慢反应途径。
(四)核受体
核受体是存在于胞浆或核内的一类特异蛋白质。各种核受体蛋白的编码基因在结构上有一定的同源性,故形成一个超家族。一般可分为下列几种:类固醇激素受体,包括肾上腺皮质激素、性激素受体家族;甲状腺激素受体家族;维生素D受体家族;维甲酸受体家族。此类受体虽然都称之为核受体,但一些受体在未被激活时,可能位于胞浆,但发挥作用的部位均是在核内。核受体通常处于非活化状态,需经活化才能发挥作用。活化是指核受体由无转录活性转为能与靶基因结合,并启动转录的过程,受体的活化通常是配体依赖性的。在无相应配体结合时,它们也能与靶基因结合,但不启动转录,可能是由于结合着一些抑制蛋白所致,在结合了配体之后,使抑制蛋白移除,同时还使受体磷酸化修饰,改变其构象,促进其与靶基因结合,并启动基因转录。 第三节 细胞的生物电现象
(Bioelectrical phenomena of the cell)
生物电即生物体内的电现象,是极其普遍而又重要的生命活动。同时生物电又与其它重要的生命活动紧密联系在一起,临床上一些常用的辅助检查如心电图,脑电图就是心肌及脑组织的电活动描记图。因此研究生物电对了解基本的生命活动尤其是一些特定组织,如神经系统和肌肉的机能活动具有极其重要的意义。就细胞水平来说,生物电是指位于细胞膜两侧的电位差,通常也称作跨膜电位。因为对于具有正常结构及功能的细胞来说,膜两侧的电位总是不相等的,即膜两侧具有电位差。而且不同类型的细胞或细胞在不同的功能状态下,电位差也不是恒定不变的。研究生物电即探讨细胞的跨膜电位、跨膜电位的产生原理及其变化规律。生物电现象主要包括细胞在安静时具有的静息电位和受刺激后产生的动作电位及局部电位。
一、 生物电现象
(Bioelectrical phenomena)
(一)静息电位
静息电位(resting potential,RP)是指细胞在静息未受刺激时存在于膜两侧的电位差。静息电位的记录需要一些特殊的实验装置,主要包括能显示电位变化的示波器和尖端很细并能插入细胞的记录电极。如图(2-6)所示,当两电极都处于膜外时,示波器不显示电位变化,而且任意移动电极位置,结果亦无差异。这意味着细胞外表面任意两点间电位相等而无电位差。若将其中一个尖端很细(<1μm)的金属微电极或灌注有导电液体的玻璃微电极刺入膜内,另一个仍留在膜外时,示波器上立即显示有明显的电位变化,说明膜两侧具有电位差,此即静息电位。在膜电位测量时通常将膜外电极接地,使其固定在零电位,则安静时记录到的膜内电位一般均为负值,范围在-10~-100mV。如骨骼肌细胞约为-90mV,而神经元细胞体为-70mV。静息电位是一稳定的直流电位,只要细胞未受刺激并且代谢维持正常,膜内负电位就恒定地持续下去。静息电位(以及其它形式的膜电位)习惯上以膜外电位为零时的膜内电位的数值来表示。膜电位的绝对值代表电位差的大小,而膜电位的符号说明了膜内电位与膜外电位的关系。例如,静息电位为-90mV的表述有两层含义,一是说明膜内外电位差为90mV,又由于膜内电位是负值,说明膜内电位低于膜外90mV。而膜电位发生变化时,如由-90mV变为-100mV,负值增大(绝对值增大),也称为膜电位增大(电位差增大);反之,当-90mV变为-70mV时,则称为膜电位减小,而此时膜内电位较静息时升高了。静息电位的产生是由于膜两侧不同极性的电荷积聚的结果(见后),把这种静息时位于膜两侧电荷(外正内负)的分极状态称作极化(polarization)。当膜电位增大(如-90mV变为-100mV)时,称为超极化(hyperpolarization);当膜电位减小(如由-90mV变为-70mV)时,称为去极化(depolarization);细胞在发生去极化后膜电位再向静息电位方向恢复的过程,称为复极化(repolarization)。
(二)动作电位
以神经和骨骼肌为代表的可兴奋细胞(excitable cells),在受到适当刺激后,其膜电位将发生短暂的、可扩布的电位变化,称之为动作电位(action potential,AP)。神经细胞的动作电位包括锋电位和后电位两部分,其过程为受刺激后膜电位由静息时的-70mV快速地升高,并逆转成为+30mV,即膜电位发生了快速和大幅度的去极化变化。通常将去极化超过0mV的部分称为超射(overshoot)。随后,膜电位又迅速复极化恢复至静息电位水平,动作电位的去极化和复极化过程进行得非常快,产生的电位变化形似尖耸的锋,称为锋电位(spike or spike potential),神经和骨骼肌的锋电位持续时间约1~2ms。锋电位在恢复至静息水平之前,会经历一个缓慢而小的电位波动称为后电位,它包括负后电位和正后电位。前者指膜电位复极到静息电位水平前维持一段较长时间的去极化状态,后者是紧随其后的一段超过静息电位水平的超极化状态,最后才恢复到受刺激前的静息电位水平。负后电位和正后电位的名称都是延用细胞外记录时的命名。因为在采用细胞外记录方法时,两个电极都被放置在细胞外以记录细胞外两点间的电位差。此时发生超极化的部位其电位会高于正常部位,因而将超极化的电位变化取名为正后电位。
不同类型细胞的动作电位其时程及形状会有很大差异。如心肌细胞的动作电位持续时间会超过100ms,而且电位变化还会包含有不同的时相(见第四章第一节)。但所有细胞的动作电位都具有一些共同的特征:①动作电位是兴奋的标志,对神经细胞和肌细胞来说兴奋即意味着动作电位的产生;②动作电位具有全或无特性,动作电位是由刺激引起细胞产生的去极化过程。而且刺激必须达到一定强度,使去极化达到一定程度(见后),才能引发动作电位。对于同一类型的单细胞来说一旦产生动作电位,其形状和幅度将保持不变,即使增加刺激强度动作电位幅度也不再增加,这种特性称为动作电位的全或无(all or none)现象。即动作电位要么不产生要产生就是最大幅度;③动作电位可以进行不衰减的传导,动作电位产生后不停留在受刺激的部位,而是迅速沿细胞膜向周围扩布,直到整个细胞都历经相同的电位变化。在此传导过程中,动作电位的波形和幅度始终保持不变;④动作电位之后具有不应期,一次刺激引起的动作电位主要是在锋电位期间,细胞将失去对其它刺激的反应能力,这段时间称作不应期。此时细胞的兴奋性很低,必须经过一段时间的恢复,方能再接受刺激产生动作电位。
二、生物电的产生机制
(Generation of bioelectricity )
对膜电位机制的探讨至少可追溯到上世纪初,Bernstein依据当时电化学的理论最先提出膜电位可能是由离子跨膜移动而形成。为了验证有关理论,后来的研究者做了大量工作,其中三十年代由剑桥大学Hodgkin和Huxley在枪乌贼巨轴突所做的实验尤为引人注目。枪乌贼是一种软体动物,其轴突直径可达1mm。因此在当时没有微电极的条件下,可以使用较粗的电极对膜内电位进行测量。Hodgkin和Huxley分析了细胞电变化和膜两侧离子分布以及膜通透性随刺激而改变的关系,并创立了生物电产生机制的一整套理论,因此荣获了诺贝尔生理学及医学奖。
(一)静息电位形成原理-K+平衡电位
在生理条件下细胞内外的离子呈现不均匀分布。如细胞外正离子以Na+为主,而负离子以Cl-为主,它们的浓度远高于胞内Na+、Cl-的浓度;而细胞内正离子以K+为主,负离子以大分子蛋白质为主,其浓度同样远高于胞外。假定静息时膜只对K+有通透性,则K+由于浓度差而由膜内向膜外扩散。由于带负电荷的蛋白质不能同时随K+扩散,而且对K+的跨膜扩散还具有静电吸引作用。因此,K+的扩散形成了两个结果,一是扩散出来的K+只能分布在膜外近1μm厚度的表面,而不能自由扩散到细胞外液;二是扩散至膜外的K+在膜的外表面聚积形成一个正电场,由此而形成排斥细胞内K+进一步向外扩散的力量。因此,在K+跨膜扩散过程中,通常有两个作用力在同时起作用,即K+的浓度梯度促使离子跨膜移动的驱动力及膜外聚积的K+形成的阻止其继续扩散的作用力。浓度差、电位差(电场力)对离子作用力的代数和构成该离子跨膜扩散的电化学推动力。对于K+来说,浓度梯度促使K+向外扩散而电场力阻止K+向外扩散。随着K+的外向扩散,膜的外表面积聚的K+越来越多,即电场力的作用将越来越大,当它最后增大到与K+离子向外扩散的驱动力相等时,不再出现K+的净外流,而膜电位也将维持在这一平衡状态。此时的跨膜电位(静息电位)亦称K+的平衡电位(equilibrium potential,Ek)。早期枪乌贼巨轴突的电生理实验也证实了静息电位是由K+跨膜移动而形成的事实。在记录静息膜电位时,人为改变灌流液中K+的浓度即改变了K+的浓度差时,记录到的膜电位会因此改变。随着膜内外K+浓度差的减小,膜电位将会减小直至为零。Ek取决于细胞内外K+的浓度差,其数值可通过Nernst公式进行计算,即
其中Ek代表K+的平衡电位,R是通用气体常数,T是绝对温度,Z是离子价,F是Faraday常数,[K+]o和[K+]i分别代表膜外和膜内K+的浓度。为计算方便,这个公式也可简化为
将细胞内外K+的浓度(分别为140和5mmol/L)带入公式,计算出K+的平衡电位数值为-87mV。然而实际测得的静息电位虽然和理论值相近,却总是小于由Nernst公式计算的平衡电位值。这是因为静息时膜并非只对K+通透,而对Na+也有一定的通透性,但远小于对K+的通透性,一般认为膜对K+的通透性至少是Na+的50倍。Na+的内流使膜电位虽偏离了K+的平衡电位,但由于通透性很小,Na+的内流量也很少,因此,静息电位仍然非常接近K+的平衡电位。
Nernst公式只适用于膜对一种离子具有通透性的情况,即只有一种离子跨膜扩散而形成的膜电位。对于离子来说,跨膜扩散的动力来源于浓度梯度和电位梯度,膜电位一旦达到该离子的平衡电位,离子的电化学推动力则为零,即电场力与浓度梯度对离子的推动力大小相等,方向相反。反之,只要膜电位偏离平衡电位就会出现离子的跨膜移动。因此对一个离子来说,其电化学驱动力等于膜电位与平衡电位之差,即F=Em-Ei。其中F代表推动力,Em代表膜电位,Ei代表离子的平衡电位。除非膜电位等于离子的平衡电位,此时驱动力为零,离子净扩散也为零。只要膜电位偏离平衡电位就会产生驱动力,导致离子扩散。驱动力大小取决于膜电位偏离平衡电位的程度。了解这一点对理解生物电形成机制非常重要。因为无论是静息电位,还是动作电位,它们的形成都是离子在电化学驱动力作用下跨膜移动形成的离子电流及由此形成的膜电位变化。电生理学规定当正离子由膜外进入膜内或负离子作反向移动时形成的是内向电流,而正离子由膜内向膜外扩散,形成的是外向电流。内向电流使膜发生去极化,而外向电流使膜产生复极化或超极化。
如上所述,通常情况下的静息电位数值总是小于依Nernst公式计算所得的平衡电位值,即静息电位略小于Ek,因而会产生K+的驱动力,即少量K+由胞内流向胞外;同时由于膜对Na+也有很小通透性,再加上静息电位远离Na+的平衡电位(约为+30mV),因此也存在着Na+的少量内流。虽然漏出的K+和漏入的Na+量很少,对各自的浓度梯度没有即时影响。但长此下去终究会改变Na+、K+在细胞内外的浓度梯度。钠泵通过主动转运机制阻止Na+和K+浓度梯度的减小。钠泵将漏入细胞的Na+离子泵出,同时将漏出的K+离子泵入,从而使细胞维持Na+、K+原有的浓度梯度。钠泵的活动是每次泵出3个Na+,而泵入2个K+,使膜外增加一个额外正电荷,结果会使膜的电位差加大,即朝向超极化方向发展,因此钠泵的离子转运过程是一个生电性的活动。但这种生电性作用通常对膜电位影响不大,不超过5mV的变化。与钠泵的不对等转运相对应的是Na+、K+漏入量的差异。一个符合逻辑的推断是漏入Na+的量应大于K+的漏出量。实际情况与此相似,K+的漏出受到了不能扩散的蛋白质负离子的吸引而限制了其外流,而与Na+配对的Cl-则易于通过膜从而增加了Na+的漏入量,结果使Na+漏入的量约为K+漏出量的1.5倍,与上述每次泵出3个Na+,泵入2个K+的不对等转运匹配,从而维持了Na+、K+各自浓度的相对恒定。
综上所述,静息电位是K+扩散形成的电化学平衡电位。在静息电位形成过程中,以下三个因素至关重要:①K+在膜内外的不平衡分布及由此形成的电化学驱动力;②膜对K+、Na+离子的相对通透性,表现为静息时主要对K+有通透性;③钠泵的作用。
(二)动作电位的产生机制
1.动作电位的产生-Na+平衡电位
在确立了静息电位的离子学说后,很容易对动作电位的产生机制做出推论,即动作电位的产生也是离子跨膜移动的结果。由于Hodgkin等人观察到细胞受刺激产生动作电位时,其峰值并非为零电位,而是出现一定数值的超射而形成正电位,而且其超射值与Na+平衡电位在数值上非常接近。因而,他们提出了钠学说用以解释动作电位去极化的形成机制。前已述及,离子跨膜移动的条件,一是浓度梯度,二是膜的通透性。对正常细胞来说,各种离子的浓度梯度不变,改变的只能是膜对离子的通透性。而刺激对细胞的作用,恰恰是改变了膜对离子的通透性,使静息时膜只对K+有通透性变为主要对Na+具有通透性,再加上静息状态下,Na+具有很强的电-化学驱动力(膜内负电位对Na+的吸引及Na+由于浓度差具有的推动力)于是Na+快速内流而产生强大的内向电流,使膜快速去极化而达到超射值(Na+平衡电位)。早期Hodgkin和Huxley利用枪乌贼巨轴突的实验和后来一系列实验都证实了上述设想。当他们用蔗糖、葡萄糖和氯化胆碱溶液代替含有Na+的海水溶液时,动作电位幅度降低,且降低幅度与NaCl被替代程度成比例。图2-7显示了实验结果。曲线1代表用含NaCl的海水灌注时产生的动作电位,曲线2-8分别代表用无Na+液以不同时间替代海水时产生的动作电位。其替代时间从2秒到8秒不等,当无Na+灌注液达8s时(曲线8),外加电流的刺激将不再引起动作电位,甚至无任何反应。另外,在含Na+的海水液中记录到正常的动作电位时,应用特异性Na+通道阻断剂同样可以阻断动作电位的产生。然而,在动作电位过程中膜对Na+通透性的增加是一过性的,很快通透性便降低,膜又恢复了对K+的通透性。实验中若应用K+通道阻断剂TEA时,动作电位的上升支没有改变,而其复极过程将大大延缓。上述替代实验及应用通道阻断剂的实验都说明了膜对Na+、K+通透性的改变是形成动作电位的原因。但上述结果只是对这一结论的间接分析,并非对Na+、K+电流的直接测定。随着电压钳以及膜片钳技术的发明,这一问题得以解决。研究者可通过电压固定的方法直接测定膜电流,从而了解膜对离子的通透性的变化过程。
2.动作电位过程中膜电导的变化及测量
动作电位的一系列电位变化是由于膜通透性改变引起的跨膜离子流变化所致,即在刺激的作用下,膜通道的功能改变,表现为通透性改变引起了离子的跨膜移动及由此产生的离子电流及膜电位变化。因此研究动作电位的产生机制主要在于了解膜通道的功能特性,即通道的开闭过程及影响因素。对于通道来说,重要的特性是电导,可以近似地理解为通透性。膜电导与膜电阻成反比即G=1/R,其中G代表电导,R代表电阻。根据欧姆定律I=V/R,则电流可写成I=GV,这里I代表离子电流,V代表离子受到的电-化学驱动力。如前所述,离子的电-化学驱动力(F)等于膜电位(Em)与离子平衡电位(Ei)之差。因此,上式也可改写成I=G(Em-Ei)。事实上这是离子跨膜扩散过程的数学表达式。离子的跨膜扩散可形成离子电流(I),而扩散需要具备两个条件,一是膜对离子的通透性或膜电导(G),另一个是推动离子扩散的动力即电-化学驱动力(Em-Ei)。对Na+来说,其膜电导、电流及驱动力的关系如下:INa=gNa(Em-ENa),式中ENa即Na+的平衡电位(约+30mV),它只取决于膜内外Na+的浓度差,通常是保持不变的,若Em也能保持不变,测量得到的INa即可反映膜对Na+的电导。但长期以来困扰研究者,使他们不能直接测量膜电导的原因在于,动作电位去极化过程中,Em和电导总是处在一个动态的变化中,而且两者又在相互影响。膜电导增加引起的离子电流会改变膜电位,而膜电位的改变又反过来影响通透性或电导,即膜对Na+的电导并非保持恒定,而是随着膜电位的变化而变化。因而人们无法用常规的测量电流的方法获取有关电导的信息。从公式中能看得出,解决这一问题的核心是将膜电位稳定地维持在某一水平,在此情况下记录膜电流即可反映在这一膜电位水平下膜电导的情况。五十年代,Hodgkin和Huxley根据Cole和Marment早期的设计并加以改进,首次应用电压钳(Voltage clamp)技术对枪乌贼的标本进行膜电流的测定并获得了成功,取得了具有划时代意义的结果。电压钳的基本原理是利用反馈电路人为地将膜电位设定在某个水平,此时由于膜通透性的改变将产生膜电流,通过插入到细胞内的电极向细胞内注入电流,并保证注入的电流与跨膜扩散的离子电流大小相等方向相反。由此得到的结果,首先是保证了膜电位始终维持在指令电位的水平;其次通过电流监测装置,可记录到补充入胞内的注入电流,它相当于离子电流的反向电流。这样便可测定在不同膜电位水平的离子电流,从而了解膜通道的电导及功能活动。电压钳装置如图2-8所示,其核心是一个含有差分放大器(FBA)的负反馈电路。它有两个输入端,一个输出端。一个输入端连接的是插入到细胞内的微电极,经此电极可将记录的膜电位Em经高阻抗前极放大器(XI)输入到负反馈放大器,同时可监测膜电位,此电极也称为电压电极;另一输入端则接受一个人为设定的指令电位C。放大器的输出端与一个插入到胞内的电极相连以便注入电流,此电极称作电流电极。若测量到的膜电位Em与指令电压Ec相等,则输出端电流为零。当两者出现任何差异时,其差值都将反馈到放大器,放大器的输出端会输出一个极性相反的电流,以减少Em和Ec的差别,并使Em稳定在Ec的水平。而记录到的则正好是注入的电流,只是与跨膜离子电流方向相反,称作离子电流的镜向电流。图2-9所示在枪乌贼巨轴突的一个电压钳实验记录,当将电压由静息时的-60mV钳制到0mV,持续一段时间,并观察离子电流的情况,可以发现先后有两种离子电流,早期向下的内向电流和延迟的向上的外向电流。电生理学将向下的电流规定为内向电流,向上的规定为外向电流。因为当放大器注入一个方向向下能使细胞产生超极化的电流时,意味着此时膜产生的是去极化的内向电流;相反,注入向上的使细胞产生去极化的电流时,膜产生的是超极化的外向电流。利用单一的电压钳技术只能记录电流的方向及幅度,而无法对电流的离子成分进行分析。要进行这样的分析需结合其它方法如离子替换法或应用离子通道的特异性阻断剂等。图中同时显示了在应用Na+通道阻断剂TTX和K+通道阻断剂TEA后分别记录到的膜电流。当应用TTX后由于阻断了Na+通道,因而记录到的只有单一的外向电流;同理在应用TEA后由于阻断了K+通道而只能记录到单一的内向电流。上述结果说明了内向电流的离子成份是Na+,而外向电流的成份是K+。在电压钳实验中,通过人为设定钳制电压水平并记录膜电流,可计算在不同膜电位时膜电导的变化。图2-10显示了将膜电位钳制在去极化过程的不同电位,记录电流然后计算膜对Na+的电导。结果显示,在去极化过程,膜对Na+的电导并非恒定,而是随着去极化的进行,对Na+的电导逐步增加,这称为Na+电导的电压依赖性,即Na+电导的大小受膜电位影响。Na+电导的电压依赖性,对解释动作电位过程出现再生性去极化具有非常重要的意义(见后)。电压钳实验为形成动作电位的离子学说提供了直接证据,即在刺激作用下膜对各离子的电导依次发生了改变,从而形成了一系列电位变化。首先是Na+电导急骤增加,Na+快速内流形成的内向电流使膜内电位迅速升高直至接近Na+平衡电位,形成去极化的升支部分;随后Na+电导又迅速降低,K+电导增大,K+外流形成外向电流,使膜发生快速复极化,构成动作电位的降支。显然,上述膜电导的变化应该是建立在通道构型或功能改变的基础上。遗憾的是,到目前为止我们对通道在受刺激后引起的构型改变及作用模式仍不甚明了。比较明确的是,在不同的膜电位水平或动作电位的过程中,Na+通道呈现三种基本功能状态:①备用状态,其特征是通道呈现关闭状态,因而对离子不导通,但对刺激可发生反应而迅速开放,因此称作备用状态;②激活状态,此时通道开放,离子可经由通道进行跨膜扩散;③失活状态,此时通道关闭离子不能进出,即使有刺激也不能立即开放。细胞在静息状态即未受刺激时,通道处于备用状态。当刺激作用于细胞时通道被激活而开放。多数通道开放的时间很短,如前述锋电位过程的Na+通道开放时间仅为1~2ms,随即进入失活状态。必须经过一段时间,通道才能由失活状态恢复至静息的备用状态。上述有关通道的功能状态,决定着细胞是否具有产生动作电位的能力,与不应期(见后)的产生有密切联系。
利用电压钳技术可定量分析刺激作用于细胞后膜电导的变化,然而得到的结果是整个细胞膜上所有通道活动的综合结果,利用此项技术尚不能了解单个离子通道的功能活动特征。因为电压钳的钳制面积大,包含大量随机开放和关闭的通道,形成的背景噪音也大,往往掩盖了单一通道的微弱电流,且对体积较小的神经元要插入两个电极也是非常困难的。1976年由Neher和Sakmann发明的膜片钳(Patch clamp)技术解决了这一难题。膜片钳与电压钳的工作原理基本相同,即在人为设置电压并固定的情况下,记录分析离子电流。只是膜片钳技术能够在一小片膜上记录到单个离子通道活动形成的电流。利用微电极尖端把通常只含有1~3个离子通道,面积约1平方微米的一小片膜通过负压吸引并封接。由于电极尖端与细胞膜的高阻封接,使电极尖端吸引的一小片膜与细胞膜的其它部分在电学上完全隔离(图2-11)。用一个极其敏感的电流监视器(膜片钳放大器)即可测量并记录到单个通道的电流(图2-12)。由记录到的单通道电流可知,通道呈现两种状态即开放和关闭,开放时可形成pA级的电流(10-12安培)。通过对几十甚至上百次开闭过程的观察,可统计通道的平均开放与关闭时间,并可根据记录的电流及钳制的电位计算出通道的电导。上述电压钳及膜片钳的实验资料从整个细胞膜及单个通道的不同角度说明动作电位过程发生的膜电导变化及相应机制,即刺激作用后引起离子通道的功能变化,表现为通道的开闭进而形成整个细胞电导的变化,由此产生了早期Na+内流的去极化及随后K+外流的复极化过程。伴随细胞动作电位的发生,总有一部分Na+进入细胞,一部分K+流出细胞。事实上一次动作电位过程离子跨膜移动的量包括Na+的进入及K+的外流量只占膜外Na+及膜内K+总量的极少部分,短时间不会改变Na+、K+在膜内外的分布及浓度梯度。但长此下去最终会引起Na+、K+浓度的改变,从而影响细胞产生动作电位的能力。钠泵通过消耗能量完成离子的主动转运,泵出动作电位产生过程中进入胞内的Na+,摄入排出的K+,从而恢复离子浓度。钠泵对胞内Na+浓度的增加非常敏感,因此在动作电位之后,由于Na+内流引起的胞内Na+浓度的增高会启动钠泵的活动,实现离子转运。正如前述,钠泵的活动是每次泵出3个Na+泵入2个K+,是一个生电性过程,而发生正后电位时的超极化可能与钠泵的这种生电性作用有关。
3.动作电位产生的条件
动作电位是指受刺激后膜电位产生的特征性的电位变化。对细胞来说,体内自然条件下的刺激通常依赖于各种信号的传递。如来自神经纤维的信号(动作电位)经神经-肌肉接头的兴奋传递使肌肉受到刺激产生兴奋。而体外的人工刺激通常是给予电刺激。无论是体内的自然刺激还是人工电刺激产生的动作电位,其去极化的电位变化都包括两部分,即初始的去极化以及达到阈电位后的再生性去极化。初始去极化是指刺激作用于细胞首先产生的去极化反应,包括人工电刺激电流在膜上引起的电位变化及膜上少量Na+通道开放形成的去极化反应。若刺激强度小,产生的去极化会被K+外流所抵消,而不能形成动作电位。但若刺激强度增大,Na+的内流量随之增加,因而去极化幅度增加,当达到某个临界值即阈电位时,即可触发动作电位。因此,阈电位是指能使去极化转变为锋电位的临界膜电位值。是生物电中一个非常重要的概念,达到阈电位意味着此时Na+的跨膜内流量将大于K+外流的量,它的重要性在于此时膜的去极化将不再是刺激依赖性的,因为即便去除刺激,膜电位仍然会稳定于阈电位水平(通常较静息电位小10~20mV)。事实上膜电位并不停留在阈电位的水平,而是快速去极化形成一个再生性过程。因为Na+通道具有的一个重要特征是电压依赖性,即去极化会使Na+的电导增加,即更多的Na+通道开放,Na+内流加速,由此发生的去极化会进一步增加Na+电导从而形成一种正反馈过程或再生性去极化。这里的再生性去极化是指Na+的通透性随去极化程度的增加而增大,从而形成通透性越来越大和去极过程越来越快的现象。由此,在极短的时间Na+内流大大超过了K+外流,产生大幅度的去极化直至达超射值,从而形成动作电位曲线的上升支(图2-13)。上述过程不难看出,在动作电位的产生过程中,阈电位发挥着类似触发开关的作用,只要刺激引起膜的去极化达到阈电位,就可引起动作电位。而产生的动作电位的幅度、形状及时间进程则只取决于膜电导,Na+浓度梯度和兴奋前膜电位水平,而与引起动作电位的刺激无关。不管什么性质的刺激,只要使膜电位去极化达到阈电位就可触发动作电位的产生。而动作电位一旦产生,其形状、幅度及时程,均与原刺激无关,这是动作电位具有"全或无"特征的真正原因。
决定阈电位的因素主要是膜上Na+通道的密度,其次是通道对膜电位或化学刺激及机械刺激的敏感性。若通道的密度高即使较小的去极化也可达到阈电位(即Na+内流量大于K+外流量)触发动作电位。相对于正常情况来说,此时的阈电位水平下移了,如阈电位可能由正常的-50mV下移变为-55mV。同样的道理,若通道对膜电位的改变、化学刺激或机械刺激敏感,也可以使阈电位下移。这意味着,即使较小的膜电位变化也能引起Na+通道构型改变,使其开放而形成与正常同样大小的离子电流最终引发动作电位。
4.阈下刺激与局部兴奋
能使细胞达到阈电位的最小刺激强度称作阈强度,具有阈强度的刺激称作阈刺激。小于或大于阈刺激的分别被称为阈下或阈上刺激。只有阈刺激和阈上刺激才能引起动作电位,而阈下刺激不能使膜的去极化达阈电位,因而不能产生动作电位。但阈下刺激会使少量Na+通道开放形成小幅度的去极化反应,称为局部兴奋。局部兴奋具有的共同特征是:①刺激依赖性,其含义有两方面,一是这种小的去极化反应只在外加刺激作用时发生,刺激撤离后,其去极化很快被K+外流所抵消;其次去极化幅度随阈下刺激的强度改变而改变,呈现一种等级性反应,不具有动作电位"全或无"的特征(图2-13);②电紧张性扩布,局部兴奋不能作长距离的扩布,但可在邻近膜形成电紧张电位,随距离延长而衰减,称电紧张性扩布。即发生在某一点的局部兴奋,其膜电位变化可通过电紧张方式使邻近部位的膜产生去极化反应,但仅限于周围几毫米的距离;③总和反应,局部兴奋的去极化反应可以相互叠加,即可发生总和。在一个较小的范围,即电紧张性扩布的范围,同时发生的局部兴奋可相互叠加,致使其去极化幅度较单一的局部兴奋的幅度大,称为局部兴奋的空间总和;总和也可以发生在某一部位连续产生局部兴奋时,由于后一次反应发生在前一次反应还未结束时,同样可使去极化反应叠加起来,这种方式称作时间总和。总和的发生首先与单一局部兴奋去极化的幅度大小有关,其次空间总和取决于同一时间发生局部兴奋的数目及空间距离,在一个局部,同时产生的局部兴奋数目多且空间距离小,易于通过电紧张的方式总和;而时间总和则取决于局部兴奋产生的频率,显而易见,局部兴奋的产生频率高,间隔时间短,容易使小幅度的去极化叠加、总和起来。因此,局部兴奋虽未形成动作电位,但通过总和可以产生动作电位,因而可看作是动作电位(或兴奋)的一种过渡形式。另外,由于局部兴奋随刺激强度大小而变化,因此具有更灵活的编码方式,因而是体内除动作电位以外的另一种非常重要的信号编码方式。尤其是在细胞间信号传递过程中,如神经-肌肉接头及神经元之间突触的信息传递过程中发挥重要作用。
(四)动作电位的传导
动作电位的产生通常首先发生在局部。人工电刺激时,发生在刺激电极下方,而在体的自然刺激情况下,也是首先发生在细胞受刺激的某个局部。但正如前述,动作电位的特征之一是可以迅速向周围扩布,直到整个细胞的膜历经同样的变化。如图2-14所示,动作电位首先产生于细胞中间的一点,在产生动作电位的部位,由于超射形成了膜电位极性的倒转,因此兴奋部位与邻近的膜形成了电位差,由于细胞外液与内液均为导电液体,在电位差的作用下,就会产生局部电流,局部电流将使邻近的膜产生去极化反应,一旦达到阈电位将引起动作电位发生。此处发生的动作电位以同样方式影响其邻近的膜,并依次产生动作电位。因此,动作电位的传导,实质上就是以局部电流的方式,在未兴奋的静息区由于依次接受刺激而相继产生动作电位的过程,其结果表现为产生于一点的动作电位传导到整个细胞。由此不难理解,为什么在长距离的传导过程中动作电位的幅度、形状并不发生变化,即呈现不衰减传导的特征。
上面描述的是动作电位在无髓神经纤维上的传导机制,而兴奋在有髓神经纤维的传导则有所差别。由于组成髓鞘的脂质是绝缘的,因此,兴奋区与未兴奋区产生的局部电流只能发生在相邻的朗飞氏结之间。这种方式传导的动作电位称作跳跃式传导。其结果是大大提高了动作电位的传导速度,同时也节省了能量消耗。因为在单位长度,动作电位传导过程经跳跃式传导涉及的离子进出的总量少得多,即需要主动转运的离子量减少,因而减少了能量消耗。
三、 组织的兴奋和兴奋性
(Excitability of tissue cells)
(一)刺激与兴奋
无论是在体还是离体的情况,组织的兴奋大多由刺激引起。在人工刺激的条件下,常用的刺激是电刺激,因为电刺激易于掌握参数,且重复性好。当用电流作为刺激时,需要考虑电流强度(i)、通电持续时间(t)、及电流的变化率(di/dt),这称为电刺激的三要素。但由于在实际应用时绝大多数应用直流电刺激,此时可不考虑电流的变化率,因而通常的电刺激只有两个变量,即电流强度和通电时间。当把刺激电流固定在某一强度时,逐渐延长通电时间,直到引起兴奋,然后依次改变刺激强度,由此便可求出刺激强度与必需的最短通电时间的相互关系,依两者的关系做出的曲线称为强度-时间曲线(图2-15)。由曲线可以看出,电流强度越小,引起兴奋所需的最短通电时间越长。但当电流强度小到一定程度时,即使延长通电时间也不再能引起兴奋。把能引起兴奋所需的最小刺激强度称作基强度(图中b点所对应的刺激强度)。用基强度的电流刺激组织时,引起兴奋所需的时间通常很长。采用二倍于基强度的电流刺激组织,引起兴奋所需的最短时间称作时值(图中t点对应的刺激强度),时值可用作衡量组织兴奋性的指标。
(二)兴奋性和可兴奋性组织
广义的兴奋是指组织细胞对外界刺激产生的反应。然而对大多数细胞来说兴奋就是动作电位或动作电位的产生过程。因此,现代生理学将细胞所具有的受刺激后产生动作电位的能力称兴奋性,而将能产生动作电位的神经细胞、肌细胞和一些腺细胞称作可兴奋细胞,或可兴奋组织。换句话可兴奋细胞的共同特征就是,对刺激敏感并做出反应,而且反应形式通常是动作电位。对这些组织来说,动作电位作为兴奋过程有两方面的含义,一是动作电位可引起相应的功能活动,如肌肉的动作电位引起收缩,腺细胞的动作电位引起分泌,分别称作兴奋-收缩耦联或兴奋-分泌耦联;其次对于一些特殊细胞如神经元来说,动作电位则构成了它们的主要活动形式,如神经元通过产生、传导动作电位进行信息处理,从而完成对各种生理功能的调节。
(三)细胞兴奋后兴奋性的变化
除时值外还可利用阈强度作为衡量组织兴奋性的指标。而且在实际应用时,更多地是利用阈强度来衡量组织兴奋性。在固定了刺激的通电时间后,能引起组织兴奋的最小刺激强度称作阈强度(改变刺激的通电时间,会有一个对应的阈强度值)。对不同的组织来说,阈强度大表明其兴奋性低,意味着需要更大的刺激强度才能引起兴奋,反之则意味着兴奋性高。同一组织或同一细胞的兴奋性变化也可用阈刺激来衡量,当细胞兴奋性升高时引起动作电位的阈强度会降低,反之当兴奋性降低时,需更大的刺激强度才能引起动作电位。
细胞在产生兴奋的过程及之后的一段时间,兴奋性是会发生改变的。在兴奋产生最初的一段时期,无论多么强大的刺激也不能使细胞再次兴奋,这段时间称绝对不应期(absolute refractory period)。即在此期间刺激阈值无限大,兴奋性可看作是零。绝对不应期后的一段时期,给予细胞一个强刺激,即大于阈强度的刺激可产生一个动作电位,称为相对不应期(relative refractory period)。绝对不应期后,兴奋性在逐渐恢复,但由于引起动作电位的刺激强度仍大于正常的阈强度,所以兴奋性仍低于正常。之后细胞还会经历超常期和低常期,前者是细胞的兴奋性轻度增高,而后者是兴奋性低于正常水平。
上述兴奋性变化的主要特征是,细胞在产生一次兴奋后,兴奋性要经历一个周期性变化。表现为动作电位之初兴奋性为零及之后逐渐恢复的过程。绝对不应期在时间上相当于锋电位持续的过程,这意味着锋电位是不能叠加的。即在产生动作电位过程不可能同时再接受刺激产生另一个动作电位。因此,不应期的存在限制了细胞产生动作电位的最大频率。不同的细胞由于绝对不应期长短不一,因而产生动作电位的最大频率有所差别。一些细胞的最大频率可能在100次/s,另一些可能达1000次/s。
产生不应期的原因,是由于Na+通道在接受一次刺激而激活开放后,会经历不同的功能状态。如前所述,对单一通道来说当通道受刺激开放后,随之关闭进入失活状态,而且必须经历一段时间才能恢复至备用状态,当膜上所有通道都进入失活状态时,细胞即表现为绝对不应期。之后随着复极的进行通道在逐渐复活,兴奋性也在逐渐恢复,最终在膜电位恢复至静息水平时,所有通道都恢复到备用状态,兴奋性恢复正常。
精彩图文
论坛新帖
频道总排行
医学推广
频道本月排行
- 18第十章 感觉器官的功能
- 18第五章 呼吸
- 16第六章 消化和吸收
- 13第二章 细胞的基本功能
- 10第十一章 神经系统
- 7第一章 绪论
- 4第三章 血液
- 3第七章 能量代谢
- 2第四章 血液循环
- 1第十三章 生殖
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)