克-雅病,一种令人吃惊的减退(认知和人格变化待查)
2012-04-12 21:38:20 来源:医学论坛网 作者: 评论:0 点击:
一名89岁的男性被他的妻子和儿子送到急诊室接受认知和人格变化方面的评估。6个月前,他开始需要(他人)帮助管理财务和操作他的电脑。他对近 期事件的记忆差,自我表达困难,并且变得越来越易受激惹。他还表现出不寻常的行为,例如吃香蕉皮、将牛奶倒在桌上,以及穿上衣服后立即脱掉。他开始出现行 走困难和偶尔大小便失禁。在几个月的过程中,他变得无法独立穿衣、沐浴、使用卫生间或行走。
这例患者因进行性神经系统(功能)减退(主要影响他的思维和行为)而就诊。这种认知功能(包括记忆、语言和人格)的普遍损害是痴呆的特征,被定义为认知和(或)行为进行性衰退(不伴意识损害),严重到足以影响日常生活活动。在因痴呆而就诊的患者中,应考虑各种原因,包括神经变性性、血 管性、感染性或炎性疾病,肿瘤形成,毒性或代谢性病症,脑积水,以及精神病症。该患者病史的最突出特征是认知和运动功能障碍的快速进展。在仅仅几个月内, 他已从可独立地行使功能变为无法进行基本的日常生活活动。病史中没有提示谵妄的特征,包括急性发病、波动性病程、意识障碍、睡眠-觉醒周期改变,以及精神 病的症状。因此,这种亚急性整体(认知)减退最符合快速进行性痴呆。
在短短数周至数月内进展的痴呆的最常见原因是朊病毒病,包括散发性克罗伊茨费尔特-雅各布病(克-雅病)(俗称疯牛病, 编者注)、获得性克-雅病和遗传性普里昂病。有可能导致快速进行性痴呆的其他病况包括其他神经变性性痴呆[例如额颞痴呆、皮质基底节变性、进行性核上性麻 痹、有莱维(Lewy)体的痴呆,以及阿尔茨海默病的不典型表现]和自身免疫性脑病。在较少见的情况下,血管性、感染性、肿瘤性、毒性、代谢性和精神病况 有可能导致快速进行性痴呆。
该患者有冠状动脉疾病、房颤、良性前列腺增生和腰椎狭窄史,在入院前18个月接受贫血和肾功能不全评估后,医师做出了瓦尔登斯特伦 (Waldenström)巨球蛋白血症的诊断。当时的血清蛋白电泳显示IgM副蛋白质水平升高(1638 mg/dl,参考范围40~230),分期评 估显示髓外疾病伴骨髓受累。他接受了4个周期的利妥昔单抗治疗,并且有疗效反应:他的IgM副蛋白质水平降至671 mg/dl。既往的手术包括4次冠状 动脉旁路移植术、白内障手术和腰椎间盘切除术。他(所用)的药物包括呋塞米、坦索罗辛、非那雄胺和华法林,他还服用复合维生素。该患者没有药物过敏。他有 150包/年的吸烟史,但20年前已戒烟。他在社交时饮酒,不用违禁药物。他没有国际旅行史,并且没有已知的神经系统疾病家族史。
尽管上述补充病史显示了数种有可能导致认知减退的病况,但均不太可能解释该患者的表现。房颤使栓塞性缺血性卒中危险升高,并且卒中的累积可导致 痴呆。相似地,瓦尔登斯特伦巨球蛋白血症有可能导致高黏滞性,后者可导致多发性梗死和认知功能障碍。该患者在没有提示卒中的发作情况下的快速、稳定性认知 减退不支持痴呆的血管性原因。瓦尔登斯特伦巨球蛋白血症还可导致血管周围淋巴浆细胞性浸润的发生,其与宾-尼尔(Bing-Neel)综合征(神经精神病 巨球蛋白血症综合征)中的认知减退相关,但这种罕见的病况往往导致局灶性感觉运动神经系统缺陷。在罕见的情况下,利妥昔单抗与潜在性JC病毒再活动以及进 行性多灶性白质脑病(PML)的发生相关。尽管PML患者可发生快速认知减退,但经常出现局灶性运动或感觉神经系统症状。神经系统检查时定位体征的证据和 磁共振成像(MRI)上特征性病变的检出,将为这些疾病之一的诊断提供支持。
该患者的体温为36.5°C(97.7°F), 心率61次/分钟,心律不规则(房颤),血压144/78 mmHg, 呼吸率18次/分钟。 检查时,颈、肺、腹、上下肢和淋巴结均正常。该患者警醒,能定向自己和城市,但不能确定年份。他频繁地打断检查者并且展示出不恰当的诙谐。他反复地伸手去 抓他前面的东西,包括检查者的领带和面部。他不能反向拼写“world”一词,并且不能进行100减7的连续减法。他的言语流利,但他经常用发音相似的词 替代(显示出音素性错语)。他可以立即回忆起3个单词中的3个,但5分钟后1个也回忆不起来。该患者无法遵循包括多个步骤的命令,并且无法进行简单的计 算。他不能做点烟的手势或模仿手的位置。
脑神经检查显示视野完整、瞳孔等大并且有对光反射,眼扫视运动正常,面部表情肌有力并且对称。上下肢近端和远端肌力均正常。有具临床意义的伸展 过度性[反向张力过强(gegenhalten)]强直。肌阵挛性急跳见于上肢,伴有对称的活跃反射。下肢的反射正常。巴宾斯基征不存在,也没有罕见的吃 惊反应(startle response)。轻触觉、温度觉和振动觉均存留。该患者无法行走。该患者的神经系统检查显示多发性认知域功能障碍,伴有显著 的额部网络功能障碍,表现为不恰当的诙谐(童样戏谑)、去抑制、刺激约束行为(自动伸手拿或用东西)和注意力不集中。注意力受损(当很深时)可使精神状态 检查的其他组分难以解释。显著的额部网络受损体征与人格变化联合存在加速了行为变异性额颞痴呆的考虑。然而,极其快速的进展和双侧肌阵挛的存在以及局部较 高的皮质体征(失语和失用)提示克-雅病。脑电图(EEG)的特征性结果(例如周期性尖复合波)或MRI上的特征性结果(例如皮质或深部核团的受限扩散) 进一步支持该诊断。
实验室报告显示电解质水平、肝功能和全血细胞计数的结果均正常。维生素B12水平为 223 pg/ml(165 pmol/L)[参考范围 250~900 pg/ml(184~664 pmol/L)],促甲状腺素水平为1.4 mIU/L。人类免疫缺陷病毒(HIV)的血清学检测为阴性, 血清和尿的毒理学检测也为阴性。血清IgM水平为163 mg/dl(参考范围40~230 mg/dl)。血清IgG和IgA水平均正常。血清黏度为 1.3个相对黏度单位(参考范围1.4~1.8)。
在一例因认知减退而就诊的患者,应常规进行血化学检测、全血细胞计数、维生素B12 水平测定和甲状腺功能评估,以寻找可能的可逆性促发因素。 在罕见的情况下,有明显甲状腺功能减退症的患者可发生可逆性认知损害,这类患者通常因嗜睡性意识混乱状态(而不是真正的痴呆)而就诊。尽管HIV感染可导 致一系列神经认知症状,但在这例没有感染该病毒的危险因素的老年患者,HIV相关性痴呆不太可能。他的维生素B12水平轻度异常不能解释这种严重度的综合 征,尤其是在没有维生素B12缺乏的临床表现(周围神经病变、后柱功能障碍或大红细胞性贫血)的情况下。考虑到该患者的IgM水平和血清黏度正常,瓦尔登 斯特伦巨球蛋白血症病史很可能是在他就诊后出现的。
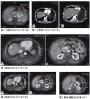
用T2-加权和液体衰减反转恢复(FLAIR)的MRI图像显示多灶性皮质表面高强度,无深部灰质结构受累(图1)。用钆后没有出血、萎缩或 (信号)异常增强的证据。EEG显示双侧θ波减慢,以及间歇性、半节律性(semirhythmic)、以额部为主的δ波,右侧多于左侧,没有癫痫样放 电,综合上述表现符合脑病(的表现)。

在快速进行性痴呆患者中,MRI上局限于皮质灰质(称为皮质带状征)和(或)深部核团(纹状体和丘脑)的受限扩散结果对克-雅病是敏感和特异 的。这种疾病的特征性EEG结果是1~2 Hz的广泛性、周期性、双相或三相尖复合波。尽管这一结果对克-雅病有高特异性,但它相对不敏感,因此在该患 者,缺乏典型的EEG结果不能排除这种疾病。
抗甲状腺过氧化物酶抗体水平为13.1 IU/ml(参考值<20),抗甲状腺球蛋白抗体未检出。血清抗核、抗中性粒细胞胞浆、抗Hu、 抗Yo、抗VGKC(抗电压门控性钾通道)、抗Ma,以及抗Ta抗体均未检出。脑脊液(CSF)分析显示葡萄糖水平为70 mg/dl(3.9 mmol /L),蛋白质水平54.2 mg/dl,无白细胞,有1个红细胞,无寡克隆带,革兰染色和培养均为阴性。14-3-3 蛋白的蛋白质印迹分析结果不具诊 断性。
进行一次有限的检查以排除可能类似克-雅病的病况是谨慎的。在神经变性性疾病(包括普里昂病)之后,自身免疫性脑炎可解释最高比例的快速进行性 痴呆病例。痴呆的自身免疫性原因包括与自身免疫性甲状腺炎相关的脑病(桥本脑病)、其他类型的非血管炎性自身免疫性炎性脑膜脑炎,以及抗体介导的脑炎(副 肿瘤性或非副肿瘤性)。这些病况通常以亚急性发病、波动性病程和CSF中的炎性变化为特征,但它们很少以一种与克-雅病相似的方式出现。尽管在克-雅病患 者的CSF中经常检出14-3-3 蛋白,但在该患者,不确定的结果无法排除这种诊断。
该患者接受了5天的静脉甲泼尼龙经验性治疗,以排除糖皮质激素反应性脑病,但他的情况没有持续改善。在接下来的3周,他的情况恶化至他无法再命 名物体或遵循指令,最终只能说出流利的无意义言语的程度。双足巴宾斯基征存在,并且发生了显著的肌阵挛和吞咽困难。当1周后(就诊后4周)该患者发生一次 误吸事件时,我们做出了放弃进一步诊断性检查和经验性治疗的决定。此后不久(他的症状出现后6个月)他死亡。
在一例可能有自身免疫性脑病的患者,大剂量糖皮质激素的经验性试验是存在争议的。对于那些没有抗体血清学证据和CSF中没有炎症指征的罕见病例 中,对糖皮质激素治疗的阳性反应有可能作为自身免疫性或炎性病程的唯一证据。该患者后来有上运动神经元功能障碍(克-雅病的另一个特征)的体征。该患者的 家族中没有朊病毒病史或医源性暴露史,最可能的诊断是散发性克-雅病。
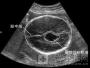
(我们)进行了尸检。脑的病理学检查显示轻度皮质萎缩,伴有遍及皮质神经毡的海绵状改变(图2)。染色显示极少量β淀粉样物质和仅有少量过度磷 酸化的tau(τ)蛋白的神经原纤维缠结。CSF分析显示τ蛋白水平升高,但14-3-3蛋白水平未升高。脑标本被送至美国国家普里昂病病理学监测中心进 行分析,用免疫组织化学和蛋白质印迹检测证实了朊蛋白的存在(图3)。基因测序证实了克-雅病MM2分子亚型的存在。
评论
由于大部分痴呆最终进展至整个神经系统功能障碍,因此关注早期临床表现和随时间变化的认知减退过程以获得诊断线索是重要的。考虑到该患者就诊时 症状的弥散性质和快速(进展)的临床病程,痴呆的常见原因(例如阿尔茨海默病)不太可能。在1年内进展至死亡的痴呆,特别是伴发运动障碍或小脑功能障碍的 痴呆,是朊病毒病的典型(表现)1,2。
克-雅病是最常见的人类普里昂病(一组有独特发病机制和传播方式的神经变性性病症)。普里昂病有可能散在发生,像感染性疾病一样被传播,或像遗 传病一样被遗传。基础原因是未知功能的正常细胞性朊蛋白(PrPSc)通过构象改变的方式转化为异常的同型异构体(PrPSc)3。这种异常的蛋白可诱导 天然朊蛋白(发生)相同的结构改变,这可解释它的感染能力。构象改变的蛋白在神经元内积聚,最终导致神经元死亡(图4)。广泛的神经元丢失可导致皮质空泡 形成(海绵状改变)和亚急性海绵状脑病的临床表现。
克-雅病有几种类型,包括散发性、家族性、医源性和变异性4。散发性克-雅病大约占病例的85%,年发病率为1例/100万人。在该型疾病中, 普里昂的初始构象改变是如何发生的尚不清楚。该病的家族型占病例的10%~15%,由朊蛋白基因(PRNP)中几种常染色体显性突变中的任何一种引起,这 些突变使正常蛋白具有自发转化为PrPSc的高倾向性。医源性克-雅病由暴露于该病患者的组织引起。
该患者的神经系统检查显示多发性认知域功能障碍,伴有显著的额部网络功能障碍,表现为不恰当的诙谐(童样戏谑)、去抑制、刺激约束行为(自动伸 手拿或用东西)和注意力不集中。注意力受损(当很深时)可使精神状态检查的其他组分难以解释。显著的额部网络受损体征与人格变化联合存在加速了行为变异性 额颞痴呆的考虑。然而,极其快速的进展和双侧肌阵挛的存在以及局部较高的皮质体征(失语和失用)提示克-雅病。脑电图(EEG)的特征性结果(例如周期性 尖复合波)或MRI上的特征性结果(例如皮质或深部核团的受限扩散)进一步支持该诊断。
实验室报告显示电解质水平、肝功能和全血细胞计数的结果均正常。维生素B12水平为 223 pg/ml(165 pmol/L)[参考范围 250~900 pg/ml(184~664 pmol/L)],促甲状腺素水平为1.4 mIU/L。人类免疫缺陷病毒(HIV)的血清学检测为阴性, 血清和尿的毒理学检测也为阴性。血清IgM水平为163 mg/dl(参考范围40~230 mg/dl)。血清IgG和IgA水平均正常。血清黏度为 1.3个相对黏度单位(参考范围1.4~1.8)。
在一例因认知减退而就诊的患者,应常规进行血化学检测、全血细胞计数、维生素B12 水平测定和甲状腺功能评估,以寻找可能的可逆性促发因素。 在罕见的情况下,有明显甲状腺功能减退症的患者可发生可逆性认知损害,这类患者通常因嗜睡性意识混乱状态(而不是真正的痴呆)而就诊。尽管HIV感染可导 致一系列神经认知症状,但在这例没有感染该病毒的危险因素的老年患者,HIV相关性痴呆不太可能。他的维生素B12水平轻度异常不能解释这种严重度的综合 征,尤其是在没有维生素B12缺乏的临床表现(周围神经病变、后柱功能障碍或大红细胞性贫血)的情况下。考虑到该患者的IgM水平和血清黏度正常,瓦尔登 斯特伦巨球蛋白血症病史很可能是在他就诊后出现的。
用T2-加权和液体衰减反转恢复(FLAIR)的MRI图像显示多灶性皮质表面高强度,无深部灰质结构受累(图1)。用钆后没有出血、萎缩或 (信号)异常增强的证据。EEG显示双侧θ波减慢,以及间歇性、半节律性(semirhythmic)、以额部为主的δ波,右侧多于左侧,没有癫痫样放 电,综合上述表现符合脑病(的表现)。
在快速进行性痴呆患者中,MRI上局限于皮质灰质(称为皮质带状征)和(或)深部核团(纹状体和丘脑)的受限扩散结果对克-雅病是敏感和特异 的。这种疾病的特征性EEG结果是1~2 Hz的广泛性、周期性、双相或三相尖复合波。尽管这一结果对克-雅病有高特异性,但它相对不敏感,因此在该患 者,缺乏典型的EEG结果不能排除这种疾病。
抗甲状腺过氧化物酶抗体水平为13.1 IU/ml(参考值<20),抗甲状腺球蛋白抗体未检出。血清抗核、抗中性粒细胞胞浆、抗Hu、 抗Yo、抗VGKC(抗电压门控性钾通道)、抗Ma,以及抗Ta抗体均未检出。脑脊液(CSF)分析显示葡萄糖水平为70 mg/dl(3.9 mmol /L),蛋白质水平54.2 mg/dl,无白细胞,有1个红细胞,无寡克隆带,革兰染色和培养均为阴性。14-3-3 蛋白的蛋白质印迹分析结果不具诊 断性。
进行一次有限的检查以排除可能类似克-雅病的病况是谨慎的。在神经变性性疾病(包括普里昂病)之后,自身免疫性脑炎可解释最高比例的快速进行性 痴呆病例。痴呆的自身免疫性原因包括与自身免疫性甲状腺炎相关的脑病(桥本脑病)、其他类型的非血管炎性自身免疫性炎性脑膜脑炎,以及抗体介导的脑炎(副 肿瘤性或非副肿瘤性)。这些病况通常以亚急性发病、波动性病程和CSF中的炎性变化为特征,但它们很少以一种与克-雅病相似的方式出现。尽管在克-雅病患 者的CSF中经常检出14-3-3 蛋白,但在该患者,不确定的结果无法排除这种诊断。
该患者接受了5天的静脉甲泼尼龙经验性治疗,以排除糖皮质激素反应性脑病,但他的情况没有持续改善。在接下来的3周,他的情况恶化至他无法再命 名物体或遵循指令,最终只能说出流利的无意义言语的程度。双足巴宾斯基征存在,并且发生了显著的肌阵挛和吞咽困难。当1周后(就诊后4周)该患者发生一次 误吸事件时,我们做出了放弃进一步诊断性检查和经验性治疗的决定。此后不久(他的症状出现后6个月)他死亡。
在一例可能有自身免疫性脑病的患者,大剂量糖皮质激素的经验性试验是存在争议的。对于那些没有抗体血清学证据和CSF中没有炎症指征的罕见病例 中,对糖皮质激素治疗的阳性反应有可能作为自身免疫性或炎性病程的唯一证据。该患者后来有上运动神经元功能障碍(克-雅病的另一个特征)的体征。该患者的 家族中没有朊病毒病史或医源性暴露史,最可能的诊断是散发性克-雅病。
(我们)进行了尸检。脑的病理学检查显示轻度皮质萎缩,伴有遍及皮质神经毡的海绵状改变(图2)。染色显示极少量β淀粉样物质和仅有少量过度磷 酸化的tau(τ)蛋白的神经原纤维缠结。CSF分析显示τ蛋白水平升高,但14-3-3蛋白水平未升高。脑标本被送至美国国家普里昂病病理学监测中心进 行分析,用免疫组织化学和蛋白质印迹检测证实了朊蛋白的存在(图3)。基因测序证实了克-雅病MM2分子亚型的存在。

由于大部分痴呆最终进展至整个神经系统功能障碍,因此关注早期临床表现和随时间变化的认知减退过程以获得诊断线索是重要的。考虑到该患者就诊时 症状的弥散性质和快速(进展)的临床病程,痴呆的常见原因(例如阿尔茨海默病)不太可能。在1年内进展至死亡的痴呆,特别是伴发运动障碍或小脑功能障碍的 痴呆,是朊病毒病的典型(表现)1,2。
克-雅病是最常见的人类普里昂病(一组有独特发病机制和传播方式的神经变性性病症)。普里昂病有可能散在发生,像感染性疾病一样被传播,或像遗 传病一样被遗传。基础原因是未知功能的正常细胞性朊蛋白(PrPSc)通过构象改变的方式转化为异常的同型异构体(PrPSc)3。这种异常的蛋白可诱导 天然朊蛋白(发生)相同的结构改变,这可解释它的感染能力。构象改变的蛋白在神经元内积聚,最终导致神经元死亡(图4)。广泛的神经元丢失可导致皮质空泡 形成(海绵状改变)和亚急性海绵状脑病的临床表现。
克-雅病有几种类型,包括散发性、家族性、医源性和变异性4。散发性克-雅病大约占病例的85%,年发病率为1例/100万人。在该型疾病中, 普里昂的初始构象改变是如何发生的尚不清楚。该病的家族型占病例的10%~15%,由朊蛋白基因(PRNP)中几种常染色体显性突变中的任何一种引起,这 些突变使正常蛋白具有自发转化为PrPSc的高倾向性。医源性克-雅病由暴露于该病患者的组织引起。这些病例罕见(占克-雅病所有病例的<1%),并且大 部分被追踪到(曾)暴露于尸体的人类垂体激素或硬脑膜移植物,尽管由角膜移植、肝移植或暴露于被污染的神经外科仪器引起的病例已有报告。器官捐赠和外科操 作的改变已大大减少了这些危险。变异型克-雅病是一种由摄入导致牛海绵状脑病的普里昂所致的人类普里昂病5。大多数病例发生于英国和法国。
克-雅病往往导致快速认知减退和肌阵挛,尽管其可产生多种神经系统症状,包括视觉、椎体、锥体外、眼球运动、精神和感觉症状,以及共济失调和失 眠。基于朊蛋白密码子129的甲硫氨酸-缬氨酸(M-V)多态性类型和朊蛋白类型(PrPSc1型或PrPSc2型),已有6种表型变异体被辨 别:MM1/MV1、MV2、VV2、MM2-皮质、MM2-丘脑和 VV16。亚型随着典型的发病年龄、疾病持续时间、发病时和疾病过程中的症状、 EEG结果的敏感性和14-3-3蛋白的CSF检测、MRI上所见改变的分布以及死后病理检查结果的性质而变化。例如,有MM1/MV1变异体的患者有可 能因显著的早期视觉症状而就诊,而有MV2和VV2变异体的患者有可能因共济失调而就诊,那些有MM2-丘脑变异体的患者则有可能因早期精神症状或失眠而 就诊。
MM2-皮质变异体(在该患者被辨别出来)不常见,大约占克-雅病散发病例的2%。这种变异体的典型发病年龄为65~69岁,通常疾病持续时 间>1年。然而,我们描述的这个病例不符合上述特征,显著的认知缺陷和MRI上孤立的皮质受累表现以及EEG不存在周期性双相或三相尖复合波是这一亚型的 特征6 。(如果)不考虑表型变异体,痴呆成为绝大多数病例的主要特征,最终导致营养不足和死亡。
普里昂病的确诊需要脑组织的病理学分析中蛋白酶抵抗性PrPSc结果阳性,尽管最近有人报告了一种有独特病理学特征的新型蛋白酶敏感性普里昂病 7。目前,当医师怀疑普里昂病时很少进行脑活检,因为对那些暴露于(脑)组织的人有潜在危险,并且证实这种诊断将改变治疗计划的可能性低。
组织检查、EEG、MRI的结果和CSF分析不能确诊有可能强烈支持克-雅病的临床诊断。有人报告在大约44%~58%的散发性克-雅病患者和 快速进行性痴呆患者中,EEG存在特征性周期性双相或三相尖复合波,对于该病的一些变异体,这些结果高度特异(特异性92%)8,9。EEG的特征性结果 在疾病病程晚期、在老年患者、疾病快速进展的患者以及那些有散发性克-雅病最常见表型变异体(MM1/MV1)的患者中出现的可能性较大,这些结果在 MM2-皮质变异体中不常见。
已有人报告对于所有克-雅病,CSF中14-3-3蛋白水平升高的敏感性高达86%,特异性为68%~74%8,10,尽管结果有可能根据亚型 而变化。在有其他神经系统病症[包括低氧性和代谢性脑病、梗死、出血、大脑转移(瘤)、副肿瘤综合征和阿尔茨海默病]的患者中结果假阳性已有报告,这强调 了当医师解释该检测的结果时考虑临床背景的重要性。

MRI也有助于诊断。FLAIR和弥散加权成像是最敏感的序列,在83%~96%的克-雅病患者中,两者联合可显示包括皮质灰质、纹状体或丘脑 的高强度。在正确的临床背景下,这种结果的特异性为83%~93%8,11。MRI上信号变化的分布与表型变异体相关。大部分在大脑皮质中有广泛信号变化 和在纹状体或丘脑中没有信号变化的患者(正如在该患者观察到的那样)有这种疾病的MM2或VV1变异体12。
对于克-雅病(目前)没有有效的治疗。正如该病例阐述的那样,有这种疾病的患者从症状出现到终末期痴呆和死亡通常在1年内有令人吃惊的和必然的认知减退。
(N Engl J Med 2012;366:836-42.March 1,2012) [9450401]
论坛新帖
频道总排行
医学推广
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)