发热、骨质破坏1例
2012-03-08 19:57:46 来源:医学论坛网 作者: 评论:0 点击:
 |
 |
Step 1
病史回顾
患者,女性,36岁,主因“反复发热1月,腰背部疼痛伴中上腹痛20余天”入院。
1月前,患者无明显诱因出现发热,多在下午4时左右出现,一般在37~38 ℃之间,最高达38.6 ℃,数小时后可自行退热,不伴有寒战,无 头痛、咳嗽、腹泻及尿频尿痛,当时口服“消炎药”(不详),未引起注意。20余天前,患者出现腰背部酸痛,无四肢关节疼痛,未予治疗;偶有中上腹阵发性疼 痛,发作时伴反酸嗳气、恶心呕吐,约1~2小时自行缓解。发病以来,无胸闷气急,无关节肿痛、皮疹红斑、口腔溃疡、光敏脱发等。饮食睡眠可,大小便如常, 体重减轻约5 kg。
患者青年女性,发热超过2周,诊断不明,属于发热原因待查(FUO)范畴。其中感染性疾病(49.0%)、自身免疫病(16.9%)和恶性肿瘤 (14.3%)是FUO最常见的3大病因。就单个病种而言,结核病最常见(21.6%);自身免疫病中以成人斯蒂尔(Still)病(5.8%)和系统性 红斑狼疮(SLE)(3.1%)相对常见;恶性肿瘤中淋巴造血系统肿瘤(5.4%)占重要地位(以上数据为北京协和医院449例FUO病例资料分析)。
鉴于感染性疾病所占比例接近一半,应为临床首先考虑。文献提示,病毒感染、感染性心内膜炎、结核病、侵袭性深部脏器真菌感染4种情况最为多见。
该患者可以按以上思路进行鉴别诊断,但是腹痛原因尚不能明确。
Step 2
既往检查回顾
患者外院检查结果归纳如下:
血常规显示,血红蛋白100 g/L,白细胞9.30×109 /L,中性粒细胞70%,淋巴细胞22%,血小板373×109/L。尿常规未 见异常。血沉 (ESR)110 mm/h,血淀粉酶53 U/L。肝功能检查,血清球蛋白43 g/L,余无明显异常。肾功能、电解质正常。高敏C反应 蛋白(hsCRP) 164.6 mg/L。
胸部X线片未见异常,腹部彩超提示肝胆胰脾未见占位。
外院化验检查提示轻度贫血,ESR和hsCRP增高,尽管白细胞不增高,但不能完全除外感染,自身免疫性疾病也应考虑,胸部X线已排除肺炎;血淀粉酶结果初步排除急性胰腺炎,腹部彩超和肝肾功能结果亦基本排除腹腔病变可能。血清球蛋白水平升高值得引起注意。
Step 3
体格检查
体温36.4 ℃,脉搏 80 次/分,呼吸 18 次/分,血压 90/60 mmHg 。神志清晰,精神尚可,营养中等,查体合作。全身皮 肤无黄染、出血点,全身浅表淋巴结未及肿大。巩膜无黄染,睑结膜略苍白,颈软,甲状腺未及肿大。双肺呼吸音清,未及干、湿性公式音。心率80 次/分,律 齐,各瓣膜区未及杂音。腹部平软,无压痛及反跳痛,肝脾肋下未及,肝肾区无叩击痛。
体格检查除贫血表现外几乎无阳性发现。尤其反复心脏听诊未及杂音,但有赖于心脏超声的进一步检查。浅表淋巴结无肿大,考虑淋巴瘤有所牵强。腹部检查初步排除外科腹痛。自身免疫疾病仍应考虑。
实验室检查
Step 4
(患者入院后实验室检查结果,见表)
入院后检查提示进行性加重的小细胞低色素贫血,患者无失血,结合铁蛋白水平,不考虑缺铁性贫血;患者无海洋性贫血的病史及家族史;因此贫血应该 解释为基础疾病造成的慢性病性贫血(ACD)。血小板的升高首先考虑继发性改变,必要时可骨髓穿刺并行基因学检查,以排除慢性骨髓增殖性肿瘤 (cMPD)。
病毒筛查无巨细胞病毒、EB病毒等近期感染证据;风湿学检查也初步排除自身免疫性疾病,但有待于继续随访,特别是继续观察有无血管炎的证据。
血清白蛋白显著下降,但患者饮食尚可,无吸收不良的证据,考虑慢性消耗,在基本排除病毒感染、自身免疫病后,应继续寻找结核感染证据,同时肿瘤性疾病也进入临床视野。
血清球蛋白升高,但免疫固定电泳阴性,排除了浆细胞病的可能,多克隆(反应性)球蛋白升高的临床思考包括以下几个方面:①肝病,该患者无肝病的 基础;②感染,特别是慢性感染,诸如脓胸、骨髓炎,本患者也不考虑,但结核仍不能除外;③炎症,自身免疫性疾病如干燥综合征、SLE等常有球蛋白水平升 高,但该患者暂时不予考虑;④肿瘤,比如血管免疫母细胞T细胞淋巴瘤常伴有高球蛋白血症,其他肿瘤如组织细胞肿瘤也有类似表现;⑥血管滤泡淋巴组织增生症 (Castleman病)因有其固有表现,该患者不予考虑。
至此,结核感染或肿瘤性疾病,应该首先考虑。碱性磷酸酶升高目前不能解释其原因。
骨髓及影像学检查经过
Step 5
患者反复发热,体温达到39℃以上。
多次血、痰、骨髓液培养(细菌、厌氧菌、真菌)阴性,多次心脏超声未见赘生物。应用多种抗生素(主要是美罗培南+万古霉素+氟康唑)无效。
至此,可初步排除普通细菌感染性疾病的可能。
患者腹痛反复发作,且全身骨痛明显。
骨髓穿刺涂片示,骨髓增生明显活跃,粒系增生明显活跃且有毒性改变,红系增生尚可伴轻度小细胞低色素表现,巨核系增生无异常,片中浆细胞略多 见。骨髓液染色体分析提示,正常核型,淋巴细胞抗原受体基因重排均阴性。骨髓病理提示,镜下骨小梁间见大量增生造血组织,仅见少许脂肪组织,灶性纤维组织 增生,造血组织三系细胞均可见到,细胞形态及数目未见明显异常,造血组织中可见到较多浆细胞,细胞较成熟,考虑浆细胞反应增生性病变,免疫标记结果提示未 见到明确肿瘤性病变。
胸部CT,两肺、支气管未见异常,纵隔内见小淋巴结,最大者短径约0.8 cm,胸膜无增厚,双侧胸腔少量液性密度影。
发热伴骨痛,骨髓检查未见明显异常,无淋巴造血肿瘤累及骨髓证据;胸部CT提示无肺结核的依据。
胸部CT第10胸椎椎体右缘骨质不连续,提示骨质破坏,局部软组织肿胀。胸椎+颈椎MRI所见提示颈椎多发信号不匀,斜坡异常信号,考虑转移性肿瘤或血液系统病变所致;胸椎多信号不匀。由此考虑来源骨骼的造血系统肿瘤。
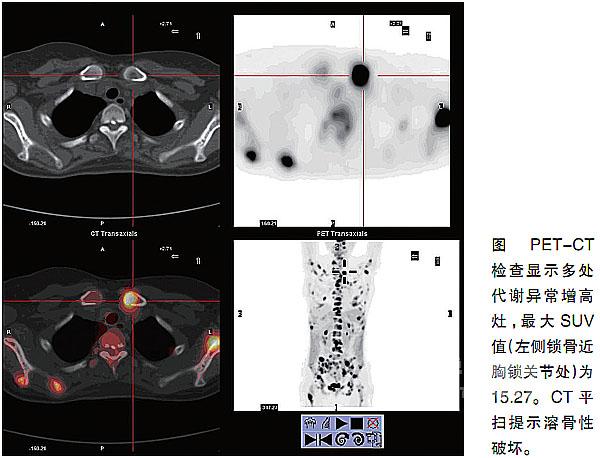
Step 6
特殊检查
行正电子发射计算机断层扫描(PET-CT)检查,可见左侧锁骨、双侧肋骨、双侧肩胛骨、肱骨头、胸骨、脊柱、骨盆、双侧股骨等多处代谢异常增高灶, 最大SUV值(左侧锁骨近胸锁关节处)为15.27,CT平扫骨窗示上述高代谢灶均为溶骨性破坏,部分伴软组织肿块形成。胸部PET图像示纵隔、左肺门可 见2处高代谢病灶,PET-
CT融合图像显示分别为1.0 cm×1.4 cm及1.0 cm×1.2 cm肿大淋巴结,其SUV值分别为7.87及3.94。纵隔见多发肿大淋巴结,最大1.2 cm×0.6 cm,最小0.6 cm×0.4 cm,不伴糖代谢异常增高。
如此广泛的骨质改变,但患者一般情况尚可,虽有发热,但毒性症状不明显,似乎不能以骨结核解释;如果是转移性骨肿瘤,病灶如此广泛,患者常进入恶病质 全身衰竭,似与表现不符;骨淋巴瘤有骨质破坏与临床表现不符,即骨质破坏严重,但临床表现较轻的特点,应该考虑;另外,朗罕氏组织细胞增多症也常有多处骨 累及的临床类型,也应考虑。
Step 7
活组织病理检查确诊
为明确肿瘤性质,在全麻下给予左锁骨近端活检。术中见有灰白色脓液涌出,送普通培养加药敏以及结核培养。吸尽脓液,见锁骨头内骨质破坏后空腔形成,周边内壁为少量肉芽样组织,予以彻底搔刮,标本送病理。
锁骨脓液样物快速结核培养阴性,抗酸染色阴性,不支持骨结核诊断。锁骨活检初步病理所见送检组织内散在异型细胞,考虑肿瘤性病变。病理科根据形态学及免疫组化(略),考虑淋巴造血系统增生性病变,但所送组织难以确定其病变类型,建议重新活检病变组织。
再次阅读PET-CT,选择左髂后上嵴为重新活检部位,在介入B超引导下穿刺活检。
病理提示,送检组织中见弥漫性组织细胞样细胞浸润,核中度异型,胞浆内多见吞噬小体,其间散在大量中性粒细胞,免疫标记结果示增生的为上皮样细胞,CD35、CD68、CD163、S100、LYSO、LCA均呈阳性反应,考虑为淋巴造血系统恶性肿瘤,符合滤泡树突细胞肉瘤。 CD68(部分+)、MH387(部分+)、S100(+)、CD1a(-)、Langerin(-)、Ki67(2%)、CD30(部分+)、 ALK(-)、LCA(+)、EMA(大细胞+)、CD3(小细胞+)、IL-4(+)、COX-2(部分+)、CD4(-)、CD8(少量+)、 CD56(-)、MPO(+)、LYSO(++)、TDT(-)、CD117(-)、CD10(少数+)、CD35(++)、CD21(-)、 CD61(-)、CD163(+)。
最后诊断:滤泡树突细胞肉瘤(follicular dendritic cell sarcoma,FDCS)
(滤泡树突细胞肉瘤临床特征、病理学免疫组化特征分析详见综述)
Step 8
治疗
住院以来,患者一般情况进行性加重恶化,消瘦明显,较入院时体重下降约5 kg,自患病以来体重下降10 kg。给予CHOP方案化疗,具体如下:环 磷酰胺1.2 g (第1日)+表柔比星100 mg (第1日)+长春地辛 4 mg (第1日)+地塞米松15 mg(第1~5日),同时予止吐、抑 酸治疗。化疗后患者情况明显改善,疼痛缓解,体温平稳。此后按原方案再次化疗,目前拟行第3次化疗。
(滤泡树突细胞肉瘤治疗及预后分析,详见综述)
■ 综述
复旦大学附属中山医院 王伟光 程韵枫
滤泡树突细胞(FDC)存在于正常淋巴结内或结外淋巴滤泡,属于一种非淋巴、非巨噬细胞系统的辅助细胞,参与抗原递呈及免疫应答反应。
滤泡树突细胞肉瘤(FDCS)是一种发生在结内和(或)结外器官的少见类型肿瘤,由门田(Monda)等于1986年最先报道。至2008年,据协和医院统计,全球报道不超过200例。
在2008年第4版WHO淋巴造血组织肿瘤分类中正式明确了滤泡树突细胞肉瘤这一名称,不再使用以往的滤泡树突细胞肿瘤,从而强调了该肿瘤作为一种肉瘤而非淋巴瘤或癌的临床生物学行为。
临床特征
多表现为淋巴结肿大及无痛性肿块,大多数病变发生在颈部、纵隔及腋下淋巴结,未有腹股沟淋巴结累及的报道。近30%的病例发生在结外如肝脾、扁桃体、腹腔内软组织等部位。
复旦大学肿瘤医院病理科回顾了自1994年至2003年,全球报道的67例结外FDCS,临床特征如下:患者年龄14~80岁,平均46岁,发病高峰 期30~70岁;女性略多见,男女比例为1:1.4;发病部位依次为肝和脾(16例)、扁桃体(8例)、小肠及其系膜(6例)、纵隔(6例)、颈部软组织 (5例)、腹膜后(5例)、咽(3例)、胰或胰旁(3例)、软腭或硬腭(2例)、鼻咽(2例)、甲状腺(2例)以及右颌下、腮腺、肺、胸壁、乳腺、胃、结 肠、直肠和周围软组织(各1例)。症状因肿瘤所处部位而异。
陈(Chan)等报道17例患者,平均年龄40岁,女性稍占优势。其中7例表现为淋巴结肿大,10例为结外肿瘤,肿瘤最大直径平均6.7 cm。比德 尔(Biddle)等报道16例头颈部结外FDCS,其中4例发生在扁桃体,4例位于咽部,2例在腭部,5例发生于软组织,1例在甲状腺。德帕斯 (De Pas)总结了自1986年至2006年共184例树突细胞肉瘤 [DCS,其中129例FDCS,55例指状突树突细胞肉瘤(IDCS)],剔 除41例(非英文),淋巴结累及60%,结外器官中肝27%、脾18%、皮肤15%、肺12%。
病因及发病机制
尚未明确,目前报道,和透明血管型的Castleman(HVCD)病有一定的相关性。Chan曾报道1例发生于鼻咽部的HVCD患者,8年后发现同时伴有FDC增生,11年后确诊为FDCS。由此推测,HVCD可能是FDCS的癌前病变。
病理学免疫组化特征
FDCS细胞通常对正常的FDC特征性标记呈阳性反应,如R4、R23、Ki-
M4、Ki-FDC1p和CD35,报道较多的阳性抗原是存在于滤泡中心细胞的细胞抗原CD21,其他报道的标记还包括HLA-DR、CD45、S100、vimentin、EMA、Ki-
67。但FDCS细胞一般对CD20、CD1a、MPO、CD34、CD79a、CD30、LCA呈阴性反应。
2002年国际淋巴瘤研究协作组(ILSG)根据61例组织细胞和树突细胞肿瘤的免疫组化分析结果,推荐应用CD21、CD35、CD1a、S100、CD68、LYS作为常规组织细胞和树突细胞肿瘤初筛抗体。
FDCS表达CD21+、CD35+、CD1a-、S100-、CD68-、LYS-。
治疗
局部病变采取手术?放疗?手术+放疗?
De Pas等复习FDCS 98例(局限性病变83例),在局限性病变中部分患者行单纯性手术治疗,其复发率近40%;对于手术后同时行辅助化疗的 患者复发率也达到了32.6%,提示在根治性手术切除后,辅助放化疗在提高患者无病生存率上没有显著意义。因此对于局限性病变患者,不支持使用放化疗等辅 助治疗手段。
对于全身病变,治疗则以化疗为主,常用CHOP方案。
预后
以往认为FDCS是一类惰性的低度恶性肿瘤,但目前的大宗病例分析和文献复习均提示FDCS具有较高的局部复发率和转移率,属于一种中度恶性肿瘤,生物学行为上更接近于肉瘤。
有学者认为FDCS如果表现出高级别特征,如弥漫性生长方式、间质内淋巴细胞较少、瘤细胞异形、有较多核分裂象和坏死,可能提示预后不良。
Chan曾认为肿瘤位于腹腔内、核分裂象>5/10 HPF、瘤细胞异型性明显和凝固性坏死均为预后不良的指标;但盐饱(Shia)等经过统计学分析后,难以将以上任何因素与预后相关。与FDCS预后相关的生物学指标尚有待于进一步探讨。
上一篇:THR失败病例分析
下一篇:低肌力能否预测未来的疾病?
论坛新帖
频道总排行
医学推广
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)





