“国内售药、国外试验”引发美国人担忧
2010-06-24 19:17:10 来源: 作者: 评论:0 点击:
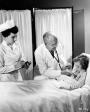
近年来,很多美国销售的药物,其人体试验是在国外进行的,这样联邦审计员无法保证药物的安全性,也难以清晰获知药物的 潜在问题。对于这一问题,医学伦理学家多年来一直在表达的担忧的态度。
根据美国卫生及人道事务部Daniel R. Levinson撰写的一份报告,2008年美国批准的药物中80%是在国外进行人体试验的,所有参与人体试验的受试者中78%是在国外招募的。2008 年批准的10个新药中,完全是在国外进行试验的,没有一个受试者是美国人。当年美国对国内1.9%的人体试验进行了现场审查,而国外仅有0.7%。药品在 国外进行临床试验时,FDA通常并不知情。这样的话,也就无法确保参与临床试验的病人得到了足够的保护。只有在公司向美国提交新药销售申请的时候,联邦审 计员才会想到应该现场审查,而此时人体试验早已结束。即便临床试验是在FDA登记的,外国受试者的份额也达到总数的1/3,而这一数字在2008年还是 13%。报告强调这一情形的高度可怕性。在国外进行低标准的临床试验,FDA缺乏必要的监督,医药企业的逐利性使得公众健康遭遇困境。
FDA对于这一说法,没有进行直接评论。审查过程的预算不足,一直困扰着FDA。对国外临床试验进行审计,向来费用惊人,每一个至少花费4万美元。 此外,FDA在报告保存、数据提交方面难以坚持标准化,为此也饱受质疑。
上一篇:世卫组织发布首份全球性儿童用药指南
下一篇:卫生部调研基本药物制度实际操作
论坛新帖
频道总排行
医学推广
频道本月排行
热门购物
评论排行
- 2011年临床执业医师考试实践技能真...(13)
- 腋臭手术视频(11)
- 2008年考研英语真题及参考答案(5)
- 节食挑食最伤女人的免疫系统(5)
- 核辐射的定义和单位(5)
- CKD患者Tm与IMT相关(5)
- 齐鲁医院普外科开展“喉返神经监护...(5)
- windows7激活工具WIN7 Activation v1.7(5)
- 正常微循环(5)
- 美大学性教育课来真的 男女上阵亲...(4)